I. Tính chất vật lí của hydrogen halide
- Hydrogen halide là hợp chất của hydrogen với halogen, công thức tổng quát HX, với X là halogen. Hậu tố “ide” trong hydrogen halide được thay thế từ hậu tố “ine” của tên halogen.
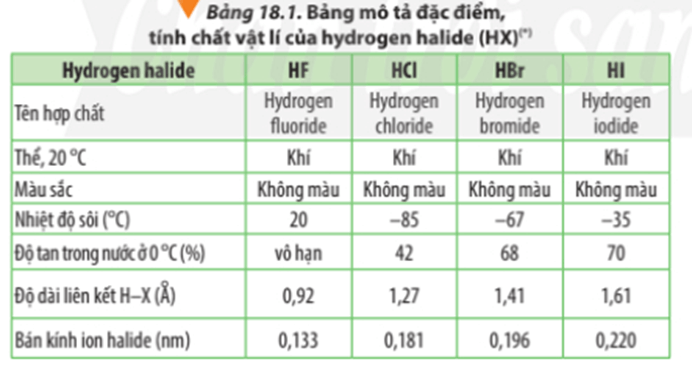
- Tử bảng mô tả đặc điểm trên, có các nhận xét sau:
+ Nhiệt độ sôi của các hydrogen halide tăng dần từ HCl đến HI.
Giải thích: Khối lượng phân tử tăng làm tăng năng lượng cần thiết cho quá trình sôi; đồng thời, sự tăng kích thước và số electron trong phân tử dẫn đến tương tác van der Waals giữa các phân tử tăng.

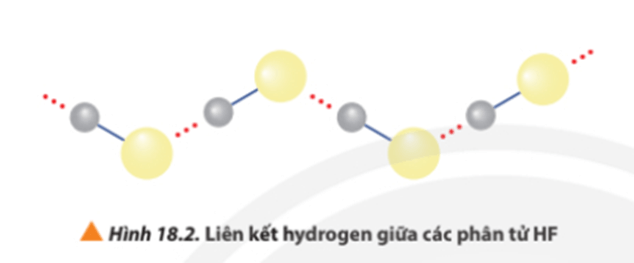
+ Các phân tử hydrogen fluoride hình thành liên kết hydrogen liên phân tử, loại liên kết này bền hơn tương tác van der Waals, nên nhiệt độ sôi của hydrogen flouride cao bất thường so với các hydrogen halide còn lại.
II. Hydrohalic acid
- Các hydrogen halide tan trong nước, tạo thành hydrohalic acid tương ứng.
- Hydrofluoric acid (HF) là acid rất yếu, nhưng có tính chất đặc biệt là ăn mòn thủy tinh, phương trình hóa học của phản ứng:
+ 4HF → ↑ + O- Các dung dịch HCl, HBr, HI là những acid mạnh, có đầy đủ tính chất hóa học chung của acid như: làm quỳ tím chuyển sang màu đỏ, tác dụng với kim loại đứng trước hydrogen trong dãy hoạt động hóa học, tác dụng với basic oxide, base và một số muối.
Chú ý: Tính acid của các hydrohalic acid tăng dần từ hydrofluoric acid đến hydroiodic acid.
III. Tính khử của các ion halide
- Trong ion halide, các halogen có số oxi hóa thấp nhất là -1, do đó ion halide chỉ thể hiện tính khử trong phản ứng oxi hóa – khử.
- Tính khử của các ion halide tăng theo chiều: < < < - Ví dụ: Khi đun nóng các muối khan halide với đặc:+ Ion chloride không khử được nên chỉ xảy ra phản ứng trao đổi.KCl + → + HCl↑+ Ion bromide khử đặc thành và bị oxi hóa thành , sản phẩm có màu vàng đậm.2KBr + → + ↑ + + O+ Ion iodide có thể khử đặc thành S, S, tùy vào điều kiện phản ứng và bị oxi hóa thành có màu đen tím.2KI + → ↓ + ↑ + + O6KI + → ↓ + S↓ + + O8KI + → + S↑ + + O
IV. Nhận biết ion halide trong dung dịch
- Phân biệt các ion , , và bằng cách cho dung dịch silver nitrate () vào dung dịch muối của chúng.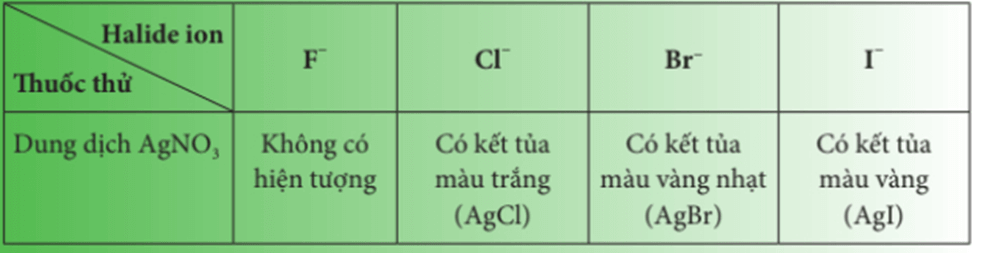
- Phương trình hóa học minh họa:
NaF + → không phản ứngNaCl + → AgCl↓ + NaBr + → AgBr↓ + NaI + → AgI↓ +
V. Ứng dụng của các hydrogen halide
- Hydrogen fluoride: Dùng để tẩy cặn trong các thiết bị trao đổi nhiệt; chất xúc tác trong các nhà máy lọc dầu, công nghệ làm giàu uranium, sản xuất dược phẩm, …
- Hydrogen chloride: Dùng để loại bỏ gỉ thép, sản xuất chất tẩy rửa nhà vệ sinh, các hợp chất vô cơ và hữu cơ phục vụ đời sống và sản xuất,…
- Hydrogen bromide: Làm chất xúc tác cho các phản ứng hữu cơ, tổng hợp chất chống cháy chứa nguyên tố bromine như tetrabromobisphenol A, điều chế nhựa epoxy, sản xuất các vi mạch điện tử.
- Hydrogen iodide: Dùng làm chất khử phổ biến trong các phản ứng hóa học; sản xuất iodine và ankyl iodide…
