Chương 5: ĐẠI CƯƠNG VỀ KIM LOẠI
CHÌA KHÓA GIẢI NHANH CÁC DẠNG BÀI TẬP KHÓ
Từ các kiến thức đã trình bày ở phần bài giảng và các dạng bài tập đã giải ở phần lời giải chi tiết các câu hỏi và bài tập cơ bản, phần các câu hỏi và bài tập mở rộng, nâng cao chúng ta nhận thấy: Để giải nhanh các dạng bài tập khó ở chương này cần chú ý:
1. Với các bài tập về xác định tên kim loại: Có thể xác định tên kim loại bằng cách:
- Dựa vào cấu hình electron của nguyên tử kim loại ⇒ Z ⇒ tên kim loại.
- Dựa vào khối lượng mol M của kim loại ⇒ tên kim loại.
- Dựa vào hệ thức giữa khối lượng mol M và hóa trị của kim loại: M = f(n) (n nguyên, dương) ⇒ tên kim loại.
Thí dụ 1: Cho cấu hình electron của một nguyên tử kim loại là: $1s^{2}2s^{2}2p^{6}3s^{2}3p^{1}$. Xác định tên kim loại đó.
Giải: Từ cấu hình trên suy ra Z = (2 + 2 + 6 + 2 + 1) = 13. Đó là Al.
Thí dụ 2: Sau khi biến đổi ta được hệ thức giữa khối lượng mol M và hóa trị n là: M = 12n. Xác định tên kim loại phù hợp.
Giải: Ta có: n = 1 thì M = 12 (không phù hợp); n = 2 thì M = 24 (phù hợp): đó là magie (Mg).
2. Với các bài tập liên quan đến phản ứng của kim loại với phi kim:
- Nắm vững tính chất hóa học chung của các kim loại:
Kim loại (trừ Pt, Au) + halogen → muối halogen
Kim loại (trừ Pt, Au) + oxi → oxit axit hoặc oxit bazơ
Kim loại (trừ Pt, Au) + lưu huỳnh → muối sunfua
- Chú ý các trường hợp đặc biệt với các kim loại nhiều hóa trị như Fe, Cu,... thì:
+ Halogen sẽ oxi hóa kim loại lên số oxi hóa cao nhất.
Thí dụ: $2Fe+3Cl_{2}\overset{t^{0}}{\rightarrow}2FeCl_{3}$
+ Lưu huỳnh chỉ oxi hóa kim loại xuống số oxi hóa thấp nhất.
Thí dụ: $Fe+S\overset{t^{0}}{\rightarrow}FeS$
Thí dụ: Cho 2,8g Fe tác dụng vừa đủ với khí clo. Tính khối lượng muối sinh ra, biết hiệu suất phản ứng là 80%.
Giải:
- Phương trình hóa học:
.png)
- Khối lượng muối sắt thu được (lí thuyết) là: x = $\large \frac{2,8.2.162,5}{2.56}$ = 8,125 g
- Khối lượng muối sắt thu được (thực tế) là: m = 8,125.$\large \frac{80}{100}$ = 6,5 g
3. Với các bài tập liên quan đến phản ứng của kim loại với nước và dung dịch kiềm:
- Nắm vững tính chất hóa học chung của các kim loại:
+ Chỉ có các kim loại kiềm, Ca, Ba, Sr mới phản ứng được với nước ở nhiệt độ thường:
Thí dụ: $2K+2H_{2}O\rightarrow 2KOH+H_{2}$
$Ca+2H_{2}O\rightarrow Ca(OH)_{2}+H_{2}$
Nhận xét: .png)
+ Chỉ có Be, Zn, Pb, Al, Cr mới phản ứng với dung dịch kiềm:
Thí dụ: $Zn+2OH^{-}\rightarrow ZnO_{2}^{2-}+H_{2}$
$Al+OH^{-}+H_{2}O\rightarrow AlO_{2}^{-}+\frac{3}{2}H_{2}$
+ Khi cho một kim loại kiềm A và một kim loại B hóa trị n vào nước thì có hai khả năng xảy ra:
• Nếu B là kim loại tan trực tiếp vào nước thì A và B đều phản ứng với nước nên:
$2A+2H_{2}O\rightarrow 2A^{+}+2OH^{-}+H_{2}$
$2B+2nH_{2}O\rightarrow 2B^{n+}+2nOH^{-}+nH_{2}$
• Nếu B là kim loại có hiđroxit lưỡng tính thì:
$2A+2H_{2}O\rightarrow 2A^{+}+2OH^{-}+H_{2}$
$2B+(4-n)OH^{-}+(n-2)H_{2}O\rightarrow BO_{2}^{(n-4)}+\frac{n}{2}H_{2}$
+ Khi bài toán cho một hỗn hợp gồm nhiều kim loại kiềm, kiềm thổ tác dụng với nước hoặc dung dịch kiềm thì có thể thay thế các kim loại trong hỗn hợp bằng một kim loại trung bình $\bar{M}$ rồi viết phương trình dưới dạng ion thu gọn và giải.
4. Với các bài tập liên quan đến phản ứng của kim loại với dung dịch axit:
- Nắm vững tính chất hóa học chung của các kim loại:
+ Với các axit mà anion của nó không có tính oxi hóa như HCl, $H_{2}SO_{4}$ loãng, $H_{3}PO_{4}$,... thì những kim loại đứng trước H trong dãy điện hóa sẽ có phản ứng với axit theo phương trình:
$M+nH^{+}\rightarrow M^{n+}+\frac{n}{2}H_{2}$
+ Với các axit mà anion của nó có tính oxi hóa như $HNO_{3}$, $H_{2}SO_{4}$ đặc thì sản phẩm thu được có thể là NO, $NO_{2}$, $N_{2}$, $NH_{3}$, $SO_{2}$, S,... Cụ thể:
• Kim loại có tính khử càng mạnh thì sản phẩm của anion gốc axit có số oxi hóa càng thấp. Thí dụ: Mg, Al, Zn có thể tạo ra các sản phẩm là $N_{2}O$, $N_{2}$, $NH_{3}$,...
• Kim loại có tính khử càng yếu thì sản phẩm của anion gốc axit có số oxi hóa càng cao. Thí dụ: Ag, Cu có thể tạo ra các sản phẩm là $NO_{2}$, NO,...
+ Với kim loại tan trong nước (kiềm, Ca, Ba,...) khi tác dụng với dung dịch axit nếu axit dư thì chỉ có phản ứng giữa kim loại và axit còn nếu kim loại dư thì ngoài phản ứng giữa kim loại và axit còn có phản ứng giữa kim loại (dư) và nước.
- Chú ý thứ tự ưu tiên khi có hỗn hợp (nhiều kim loại, nhiều axit...) như:
+ Hỗn hợp kim loại và oxit kim loại tác dụng với axit thì oxit sẽ phản ứng với axit trước rồi mới đến kim loại. Thí dụ: với hỗn hợp Cu, FeO tác dụng với $H_{2}SO_{4}$ thì FeO phản ứng trước rồi mới đến Cu...
+ Hỗn hợp nhiều kim loại tác dụng với axit thì thứ tự ưu tiên sẽ là kim loại có tính khử mạnh hơn sẽ phản ứng với axit trước rồi mới đến kim loại có tính khử yếu hơn. Thí dụ: với hỗn hợp Mg, Fe tác dụng với HCl thì Mg sẽ phản ứng trước rồi mới đến Fe...
5. Với các bài tập liên quan đến phản ứng của kim loại với dung dịch muối:
- Nắm vững tính chất hóa học chung của các kim loại: Xét kim loại A và muối của kim loại B:
+ Điều kiện: A không phản ứng với $H_{2}O$ ở nhiệt độ thường và A phải đứng trước B trong dãy điện hóa; muối A, muối B phải tan trong nước.
+ Phương trình: $nA+mB^{n+}\rightarrow nA^{m+}+mB$
Thí dụ: $Fe+Cu(NO_{3})_{2}\rightarrow Fe(NO_{3})_{2}+Cu$.png)
$Ag+Zn(NO_{3})_{2}$ → không phản ứng vì Ag đứng sau Zn trong dãy điện hóa.
Zn + PbS → không phản ứng vì PbS không tan trong nước.
+ Với các kim loại tan trong nước ở nhiệt độ thường (kiềm, kiềm thổ...) thì các kim loại này sẽ tác dụng với nước tạo ra bazơ sau đó bazơ này mới tác dụng với muối của kim loại yếu hơn tạo ra hiđroxit kết tủa. Thí dụ: cho Na vào dung dịch muối $MgCl_{2}$ thì:
$2Na+2H_{2}O\rightarrow 2NaOH+H_{2}$
$2NaOH+MgCl_{2}\rightarrow Mg(OH)_{2}$.png) + 2NaCl
+ 2NaCl
- Chú ý thứ tự ưu tiên khi có hỗn hợp (nhiều kim loại, nhiều muối...) như:
+ Hỗn hợp nhiều kim loại tác dụng với dung dịch muối thì kim loại đứng trước trong dãy điện hóa sẽ phản ứng trước với dung dịch muối rồi mới đến kim loại đứng sau (các kim loại này phải đứng trước kim loại trong muối trong dãy điện hóa và không phải là kiềm, kiềm thổ).
+ Hỗn hợp nhiều muối tác dụng với kim loại thì kim loại sẽ phản ứng với muối của kim loại hoạt động yếu hơn rồi mới đến muối của kim loại hoạt động mạnh hơn. Thí dụ: Fe với hỗn hợp muối $CuSO_{4}$ và $Ag_{2}SO_{4}$ thì Fe sẽ phản ứng với $Ag_{2}SO_{4}$ trước rồi mới đến $CuSO_{4}$...
6. Với các bài tập liên quan đến sự điện phân dung dịch:
- Khi vận dụng định luật Farađây cần chú ý:
+ Viết đúng phương trình điện phân.
+ Sử dụng định luật Farađây: m = $\large \frac{1}{F}$.$\large \frac{AIt}{n}$ (n là hóa trị của chất thoát ra).
+ Ngoài ra còn dùng các công thức khác như: pV = nRT (p tính bằng atm; V tính bằng lít; R = 0,082atm.l/mol.K; T tính bằng độ K).
- Chú ý thứ tự điện phân xảy ra tại các điện cực:
+ Ở catot: cation kim loại nhận e theo thứ tự:
$Mn^{2+}$ < $Zn^{2+}$ < $Cr^{3+}$ < $Fe^{2+}$ < $Ni^{2+}$ < $Sn^{2+}$ < $Pb^{2+}$ < $H^{+}$ < $Cu^{2+}$ < $Fe^{3+}$ < $Ag^{+}$,...
+ Ở anot: anion nhường e theo thứ tự:
$S^{2-}$ > $I^{-}$ > $Br^{-}$ > $Cl^{-}$ > $OH^{-}$ > $NO_{3}^{-}$ > $SO_{4}^{2-}$ > $CO_{3}^{2-}$,...
Thí dụ: Với hỗn hợp $HNO_{3}$ và $Fe(NO_{3})_{3}$ thì $Fe^{3+}$ điện phân trước rồi mới đến $H^{+}$...
* Hãy đối chiếu với lời giải bình thường của các dạng bài tập này và rút ra nhận xét các em nhé!!!
BÀI TẬP LUYỆN TẬP
1. Có 4 ion là $Ca^{2+}$, $Al^{3+}$, $Fe^{2+}$, $Fe^{3+}$, ion có số electron ngoài cùng nhiều nhất là
A.$Fe^{3+}$
B.$Fe^{2+}$
C.$Al^{3+}$
D.$Ca^{2+}$
2. Kim loại có tính chất vật lí chung là dẫn điện, dẫn nhiệt, dẻo và có ánh kim. Nguyên nhân của những tính chất vật lí chung của kim loại do
A. Trong tinh thể kim loại có nhiều electron độc thân.
B. Trong tinh thể kim loại có các ion dương chuyển động tự do
C. Trong tinh thể kim loại có các electron chuyển động tự do
D. Trong tinh thể kim loại có nhiều ion dương kim loại.
3. Kim loại khác nhau có độ dẫn nhiệt, dẫn nhiệt khác nhau. Sự khác nhau đó được quyết định bởi
A. Khối lượng riêng khác nhau.
B. Kiểu mạng tinh thể khác nhau.
C. Mật độ electron tự do khác nhau.
D. Mật độ ion dương khác nhau.
4. Ngâm một lá niken trong những dung dịch muối sau: $MgSO_{4}$, NaCl, $CuSO_{4}$, $AlCl_{3}$, $ZnCl_{2}$, $Pb(NO_{3})_{2}$, $AgNO_{3}$. Hãy cho biết muối nào phản ứng với Ni? Giải thích và viết phương trình hóa học.
5. Để làm sạch một mẫu thủy ngân có lẫn tạp chất là kẽm, thiếc, chì người ta khuấy mẫu thủy ngân này trong dung dịch $HgSO_{4}$ dư.
a) Hãy giải thích phương pháp làm sạch và viết các phương trình phản ứng hóa học.
b) Nếu bạc có lẫn tạp chất là các kim loại nói trên, bằng cách nào có thể loại được tạp chất? Viết phương trình hóa học.
6. Hòa tan hoàn toàn 20 gam hỗn hợp Fe và Mg trong dung dịch HCl thu được 1 gam khí $H_{2}$. Khi cô cạn dung dịch thu được bao nhiêu gam muối khan?
A. 54,5 gam.
B. 55,5 gam.
C. 56,5 gam.
D. 57,5 gam.
7. Hòa tan hoàn toàn 0,5g hỗn hợp gồm Fe và một kim loại hóa trị II trong dung dịch HCl thu được 1,12 lít $H_{2}$ ở đktc. Kim loại hóa trị II đó là
A.Mg.
B.Ca.
C.Zn.
D.Be.
8. Cho 16,2 gam kim loại M có hóa trị n tác dụng với 0,15 mol $O_{2}$. Chất rắn thu được sau phản ứng đem hòa tan vào dung dịch HCl dư thấy thoát ra 13,44 lít $H_{2}$ ở đktc. Kim loại M là
A.Fe.
B.Al.
C.Ca.
D.Mg.
9. Có 5 mẫu kim loại là Mg, Ba, Al, Fe, Ag. Nếu chỉ dùng dung dịch $H_{2}SO_{4}$ loãng thì có thể nhận biết được các kim loại :
A.Mg, Ba, Ag.
B.Mg, Ba, Al.
C.Mg, Ba, Al, Fe.
D.Mg, Ba, Al, Fe, Ag.
10. Cho bột Cu dư vào dung dịch hỗn hợp gồm $Fe(NO_{3})_{3}$ và $AgNO_{3}$. Sau khi phản ứng kết thúc thu được chất rắn A và dung dịch B. Viết phương trình hóa học của các phản ứng xảy ra và cho biết A, B gồm những chất gì. Biết rằng:
- Tính oxi hóa: $Ag^{+}$ > $Fe^{3+}$ > $Cu^{2+}$ > $Fe^{2+}$
- Tính khử: Cu > $Fe^{2+}$ > Ag.
11. Bằng những phương pháp nào có thể điều chế được Ag từ dung dịch $AgNO_{3}$, điều chế Mg từ dung dịch $MgCl_{2}$? Viết các phương trình hóa học.
12. Ngâm một vật bằng đồng có khối lượng 10 gam trong 250 gam dung dịch $AgNO_{3}$ 4%. Khi lấy vật ra thì khối lượng $AgNO_{3}$ trong dung dịch giảm 17%.
a) Viết phương trình hóa học của phản ứng và cho biết vai trò của các chất tham gia phản ứng.
b) Xác định khối lượng của vật sau phản ứng.
13. Để khử hoàn toàn 23,2 gam một oxit kim loại, cần dùng 8,96 lít $H_{2}$ (đktc). Kim loại đó là
A.Mg.
B.Cu.
C.Fe.
D.Cr.
14. Cho 9,6 gam bột kim loại M vào 400 ml dung dịch HCl 1M, khi phản ứng kết thúc thu được 5,376 lít $H_{2}$ (đktc). Kim loại M là:
A.Mg.
B.Ca.
C.Fe.
D.Ba.
15. Điện phân nóng chảy muối clorua của kim loại M. Ở catot thu được 6 gam kim loại và ở anot có 3,36 lít khí (đktc) thoát ra. Muối clorua đó là:
A.NaCl.
B.KCI.
C.$BaCl_{2}$.
D.$CaCl_{2}$.
HƯỚNG DẪN GIẢI
1. Chọn B.
2. Chọn C.
3. Chọn C.
4. Ni phản ứng với các muối: $CuSO_{4}$, $Pb(NO_{3})_{2}$, $AgNO_{3}$. Phương trình hóa học của các phản ứng:
$Ni+CuSO_{4}\rightarrow NiSO_{4}+Cu$.png)
$Ni+Pb(NO_{3})_{2}\rightarrow Pb$.png) + $Ni(NO_{3})_{2}$
+ $Ni(NO_{3})_{2}$
$Ni+2AgNO_{3}\rightarrow 2Ag$.png) + $Ni(NO_{3})_{2}$
+ $Ni(NO_{3})_{2}$
5. a) Để làm sạch một mẫu thủy ngân có lẫn tạp chất là kẽm, thiếc, chì người ta khuấy mẫu thủy ngân này trong dung dịch $HgSO_{4}$ vì:
$Zn+HgSO_{4}\rightarrow ZnSO_{4}+Hg$.png)
$Sn+HgSO_{4}\rightarrow SnSO_{4}+Hg$.png)
$Pb+HgSO_{4}\rightarrow PbSO_{4}+Hg$.png)
b) Để làm sạch một mẫu bạc có lẫn tạp chất kẽm, thiếc, chì người ta khuấy mẫu bạc này trong dung dịch $AgNO_{3}$ vì:
$Zn+2AgNO_{3}\rightarrow Zn(NO_{3})_{2}+2Ag$.png)
$Sn+2AgNO_{3}\rightarrow Sn(NO_{3})_{2}+2Ag$.png)
$Pb+2AgNO_{3}\rightarrow Pb(NO_{3})_{2}+2Ag$.png)
6. Chọn B.
- Cách 1: $n_{H_{2}}$ = $\large \frac{1}{2}$ = 0,5 mol ⇒ $n_{H^{+}}$ = 1 mol.
Trong phân tử HCl thì cứ 1 mol $H^{+}$ có 1 mol $Cl^{-}$
⇒ .png) = 20 + 35,5 = 55,5 gam.
= 20 + 35,5 = 55,5 gam.
- Cách 2: Gọi x, y lần lượt là số mol của Fe và Mg.
.png)
⇒ $\large \left\{\begin{matrix} 56x+24y=20\\ x+y=\frac{1}{2} \end{matrix}\right.$
⇒ x = y = 0,25 mol
⇒ $m_{FeCl_{2}}$ = 127.0,25 = 31,75 gam.
$m_{MgCl_{2}}$ = 95.0,25 = 23,75 gam.
m 2 muối = 55,5 gam.
7. Chọn D.
Gọi $\bar{M}$ là khối lượng mol trung bình (NTK) của hai kim loại hóa trị II. Ta có:
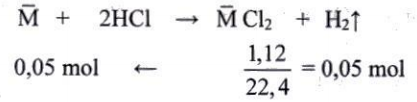
⇒ $\bar{M}$ = $\large \frac{0,5}{0,05}$ = 10
Vì sắt có NTK >10 nên kim loại còn lại phải có NTK< 10. Đó là Be (beri).
8. Chọn B.
- Phương trình hóa học:
.png)
Với: n = 1 → M = 9 (loại)
n = 2 → M = 18 (loại)
n = 3 → M = 27 (AI).
9. Chọn D.
- Khi cho 5 kim loại trên tác dụng với dung dịch $H_{2}SO_{4}$ loãng ta nhận ra được Ba (vì tạo kết tủa $BaSO_{4}$ và khí bay lên) và Ag không tác dụng
$Ba+H_{2}SO_{4}\rightarrow BaSO_{4}$.png) + $H_{2}$
+ $H_{2}$.png)
Ag + $H_{2}SO_{4}$ → không phản ứng.
- Lấy cùng khối lượng a g của 3 kim loại tác dụng với dung dịch $H_{2}SO_{4}$. Kim loại cho nhiều khí $H_{2}$ là Al, ít nhất là Fe còn lại là Mg.
.png)
.png)
10. – Phương trình hóa học của phản ứng:
$Cu+2AgNO_{3}\rightarrow Cu(NO_{3})_{2}+2Ag$.png)
$Cu+2Fe(NO_{3})_{3}\rightarrow Cu(NO_{3})_{2}+2Fe(NO_{3})_{2}$
⇒ Chất rắn A là Ag; dung dịch B là $Cu(NO_{3})_{2}$ và $Fe(NO_{3})_{2}$.
11. a) Từ dung dịch $AgNO_{3}$ điều chế Ag. Có 3 cách:
- Dùng kim loại có tính khử mạnh hơn để khử ion $Ag^{+}$:
Thí dụ: $Cu+2AgNO_{3}\rightarrow 2Ag$.png) + $Cu(NO_{3})_{2}$
+ $Cu(NO_{3})_{2}$
- Điện phân dung dịch $AgNO_{3}$:
$4AgNO_{3}+2H_{2}O\overset{dpdd}{\rightarrow}4Ag+O_{2}+4HNO_{3}$
- Nhiệt phân $AgNO_{3}$: $2AgNO_{3}\overset{t^{0}}{\rightarrow}2Ag+2NO_{2}+O_{2}$
b) Từ dung dịch $MgCl_{2}$ điều chế Mg. Cô cạn dung dịch rồi điện phân nóng chảy $MgCl_{2}$:
$MgCl_{2}\overset{dpnc}{\rightarrow}Mg+Cl_{2}$
12. a) Phương trình hóa học của phản ứng:
$Cu+2AgNO_{3}\rightarrow Cu(NO_{3})_{2}+2Ag$.png)
⇒ Cu là chất khử, $AgNO_{3}$ là chất oxi hóa.
b) Khối lượng $AgNO_{3}$ có trong 250 gam dung dịch là: $\large \frac{250.4}{100}$ = 10 gam.
- Số mol $n_{AgNO_{3}}$ tham gia phản ứng:
$n_{AgNO_{3}}$ = $\large \frac{10.17}{100.170}$ = 0,01 mol
.png)
- Khối lượng của vật sau phản ứng:
10 + 108.0,01 – 64.0,005 = 10,76 gam.
13. Chọn B.
Gọi M là kí hiệu, nguyên tử khối của kim loại. Ta có:
- Phương trình hóa học của phản ứng:
.png)
Từ phương trình trên, ta có: 23,2n = 0,4.(2M + 16n)
⇒ M = 21n, nghiệm phù hợp n = 3 ⇒ M = 63 (Cu).
14. Chọn B.
Kí hiệu kim loại là M (cũng là nguyên tử khối của kim loại):
.png)
⇒ $n_{H_{2}}$ = $\large \frac{5,376}{22,4}$ = 0,24 mol.
- Số mol $H_{2}$ do M tác dụng với $H_{2}O$ là: 0,24 – 0,2 = 0,04 mol
.png)
- Tổng số mol kim loại M là: $n_{M}$ = $\large \frac{0,4}{n}$ + $\large \frac{0,08}{n}$ = $\large \frac{0,48}{n}$
⇒ M = $\large \frac{9,6n}{0,48}$ = 20n, nghiệm phù hợp n = 2; M là Ca.
15.Chọn D.
Kí hiệu kim loại là M (cũng là nguyên tử khối của kim loại):
.png)
- Từ phương trình trên ta có: $\large \frac{6n}{2}$ = 0,15M
⇒ M = 20n, nghiệm phù hợp n = 2, M = 40 (Ca) và muối clorua là $CaCl_{2}$.
