Chương 6: KIM LOẠI KIỀM, KIM LOẠI KIỀM THỔ, NHÔM
CHÌA KHÓA GIẢI NHANH CÁC DẠNG BÀI TẬP KHÓ
Từ các kiến thức đã trình bày ở phần bài giảng và các dạng bài tập đã giải ở phần lời giải chi tiết các câu hỏi và bài tập cơ bản, phần các câu hỏi và bài tập mở rộng, nâng cao chúng ta nhận thấy: Để giải nhanh các dạng bài tập khó ở chương này cần chú ý:
1. Với các bài tập về xác định tên kim loại kiềm hoặc kiềm thổ:
- Trường hợp chỉ có một kim loại: Cách giải giống như ở mục 1: Xác định tên kim loại, chương 5: Đại cương về kim loại.
- Trường hợp có hai kim loại (A, B) thuộc hai chu kì liên tiếp trong bảng tuần hoàn:
+ Đặt tên hai kim loại đó bằng tên chung $\bar{M}$.
+ Xác định khối lượng mol của $\bar{M}$.
+ Dựa vào bảng tuần hoàn suy ra tên hai kim loại A và B, với A< $\bar{M}$ < B.
2. Với các bài tập về hợp chất của kim loại kiềm, kiềm thổ
- Các phản ứng giữa hiđroxit của kim loại kiềm với các oxit axit như $CO_{2}$, $SO_{2}$, $SO_{3}$, $P_{2}O_{5}$,... Các phản ứng có thể là:
Thí dụ: $CO_{2}+OH^{-}\rightarrow HCO_{3}^{-}$ (a)
$CO_{2}+2OH^{-}\rightarrow CO_{3}^{2-}+H_{2}O$ (b)
+ Nếu 0 < $\large \frac{n_{OH^{-}}}{n_{CO_{2}}}$ < 1: muối thu được là muối axit.
+ Nếu 1 < $\large \frac{n_{OH^{-}}}{n_{CO_{2}}}$ < 2: muối thu được là hỗn hợp của muối axit và muối trung hòa.
+ Nếu 2 $\leq$ $\large \frac{n_{OH^{-}}}{n_{CO_{2}}}$: muối thu được là muối trung hòa.
- Tính lưỡng tính của muối hiđrocacbonat của kim loại kiềm và kiềm thổ:
$HCO_{3}^{-}+OH^{-}\rightarrow CO_{3}^{2-}+H_{2}O$ (tính axit)
$HCO_{3}^{-}+H^{+}\rightarrow CO_{2}+H_{2}O$ (tính bazơ)
- Các phản ứng nhiệt phân muối hiđrocacbonat và cacbonat kim loại kiềm và kiềm thổ:
$2M(HCO_{3})_{n}\overset{t^{0}}{\rightarrow}M_{2}(CO_{3})_{n}+nCO_{2}+nH_{2}O$
$M_{2}(CO_{3})_{n}\overset{t^{0}}{\rightarrow}M_{2}O_{n}+nCO_{2}$
(n là hóa trị của kim loại).
- Để điều chế kim loại kiềm hoặc kiềm thổ người ta thường điện phân muối clorua nóng chảy:
$MCl_{n}\overset{dpnc}{\rightarrow}M+\frac{n}{2}Cl_{2}$
3. Với các bài tập về nhôm và hợp chất của nhôm
- Về độ hoạt động, nhôm là kim loại có tính khử mạnh nhưng yếu hơn kiềm và kiềm thổ; nhôm là kim loại lưỡng tính.
- Khi cho dung dịch NaOH ($OH^{-}$) vào dung dịch muối nhôm thì:
+ Trước tiên: $Al^{3+}+3OH^{-}\rightarrow Al(OH)_{3}$.png) (kết tủa)
(kết tủa)
+ Sau đó: $Al(OH)_{3}+OH^{-}\rightarrow [Al(OH)_{4}]^{-}$ (tan)
- Khi cho dung dịch axit ($H^{+}$) vào dung dịch aluminat ($[Al(OH)_{4}]^{-}$) thì:
+ Trước tiên: $[Al(OH)_{4}]^{-}+H^{+}\rightarrow Al(OH)_{3}$.png) + $H_{2}O$
+ $H_{2}O$
+ Sau đó: $Al(OH)_{3}+3H^{+}\rightarrow Al^{3+}+3H_{2}O$
- Với phản ứng nhiệt nhôm: $2yAl+3Fe_{x}O_{y}\overset{t^{0}}{\rightarrow}yAl_{2}O_{3}+3xFe$
+ Nếu phản ứng xảy ra hoàn toàn thì:
• Khi Al hết, $Fe_{x}O_{y}$ hết: hỗn hợp sau phản ứng là Fe và $Al_{2}O_{3}$.
• Khi A hết, $Fe_{x}O_{y}$ dư: hỗn hợp sau phản ứng là Fe, $Al_{2}O_{3}$ và $Fe_{x}O_{y}$ dư.
• Khi Al dư, $Fe_{x}O_{y}$ hết: hỗn hợp sau phản ứng là Fe, $Al_{2}O_{3}$ và Al dư.
+ Nếu phản ứng xảy ra không hoàn toàn thì hỗn hợp sau phản ứng sẽ có cả Al, $Fe_{x}O_{y}$ không phản ứng hết. Bài toán trở nên khá phức tạp, để giải loại toán này nên chú ý hai định luật bảo toàn khối lượng và bảo toàn nguyên tố.
Thí dụ: Điện phân nóng chảy $Al_{2}O_{3}$ với anot than chì (hiệu suất 100%) thu được m kg Al ở catot và 67,2 lít (đktc) hỗn hợp khí X có tỉ khối hơi so với hiđro là 16. Lấy 2,24 lít (ở đktc) hỗn hợp khí X sục vào dung dịch nước vôi trong (dư) thu được 2 gam kết tủa. Tính m.
Giải:
• Nhận xét:
- Khối lượng mol trung bình của X là: $\bar{M}_{X}$ = 16.2 = 32 g/mol. Vì $\bar{M}_{X}$ < $M_{CO_{2}}$ nên trong X có CO ($M_{CO}$ = 28) và $CO_{2}$, $O_{2}$.
- Số mol $CO_{2}$ có trong 2,24 lít khí X là: $\large \frac{2}{100}$ = 0,02 mol (= số mol $CaCO_{3}$ kết tủa).
- Số mol $CO_{2}$ có trong 67,2 $m^{3}$ khí X là: 0,02.$\large \frac{67,2}{2,24}$ = 0,6 mol.
- Gọi a, b là số mol của khí NO và $O_{2}$ trong hỗn hợp X, ta có:
a + b + 0,6 = $\large \frac{67,2}{22,4}$ = 3 (a)
28a + 32b + 44.0,6 = 32.3 (b)
⇒ a = 1,8 mol; b = 0,6 mol.
- Theo định luật bảo toàn nguyên tố thì:
$\tiny \sum$ $n_{O_{2}}$ = $n_{O_{2}}$ + $\large \frac{1}{2}$$n_{CO}$ + $n_{CO_{2}}$ = 2,1 mol
- Theo phản ứng: $2Al_{2}O_{3}\overset{t^{0}}{\rightarrow}4Al+3O_{2}$
⇒ $n_{Al}$ = $\large \frac{4}{3}$$n_{O_{2}}$ = $\large \frac{4}{3}$.2,1 = 2,8 mol
⇒ $m_{Al}$ = 2,8.27 = 75,6 gam.
→ Hãy đối chiếu với lời giải thông thường các dạng bài tập này và rút ra nhận xét các em nhé!!!
BÀI TẬP LUYỆN TẬP
1. Cho 3,04 gam hỗn hợp NaOH và KOH tác dụng với axit HCl thu được 4,15 gam hỗn hợp muối clorua. Khối lượng của mỗi hiđroxit trong hỗn hợp lần lượt là
A.1,17 gam và 2,98 gam.
B.1,12 gam và 1,6 gam.
C.1,12 gam và 1,92 gam.
D.0,8 gam và 2,24 gam.
2. Sục 6,72 lít khí $CO_{2}$ (đktc) vào dung dịch có chứa 0,25 mol $Ca(OH)_{2}$. Khối lượng kết tủa thu được là
A.10 gam.
B.15 gam.
C.20 gam.
D.25 gam.
3. Chất nào sau đây có thể dùng để làm mềm nước cứng có tính cứng vĩnh cửu?
A. NaCl.
B.$H_{2}SO_{4}$.
C.$Na_{2}CO_{3}$.
D.HCI.
4. Có 28,1 gam hỗn hợp $MgCO_{3}$ và $BaCO_{3}$, trong đó $MgCO_{3}$ chiếm a% khối lượng. Cho hỗn hợp trên tác dụng hết với dung dịch axit HCl để lấy khí $CO_{2}$ rồi đem sục vào dung dịch có chứa 0,2 mol $Ca(OH)_{2}$ được kết tủa B. Tính a để kết tủa B thu được là lớn nhất.
5. Cách nào sau đây thường được dùng để điều chế kim loại Ca?
A. Điện phân dung dịch $CaCl_{2}$ có màng ngăn.
B. Điện phân dung dịch $CaCl_{2}$ nóng chảy.
C. Dùng AI để khử CaO ở nhiệt độ cao.
D. Dùng kim loại Ba để đẩy Ca ra khỏi dung dịch $CaCl_{2}$.
6. Sục a mol khí $CO_{2}$ vào dung dịch $Ca(OH)_{2}$ thu được 3 gam kết tủa. Lọc tách kết tủa, dung dịch còn lại mang đun nóng thu thêm được 2 gam kết tủa nữa. Giá trị của a là
A.0,05 mol.
B.0,06 mol.
C.0,07 mol.
D.0,08 mol.
7. Nhôm bền trong môi trường không khí và nước là do
A. nhôm là kim loại kém hoạt động.
B. có màng oxit $Al_{2}O_{3}$ bền vững bảo vệ
C. có màng hiđroxit $Al(OH)_{3}$ bền vững bảo vệ
D. nhôm có tính thụ động với không khí và nước.
8. Cho 31,2 gam hỗn hợp bột Al và $Al_{2}O_{3}$ tác dụng với dung dịch NaOH dư thu được 13,44 lít $H_{2}$ ở đktc. Khối lượng từng chất trong hỗn hợp ban đầu lần lượt là
A.16,2 gam và 15 gam.
B.10,8 gam và 20,4 gam.
C.6,4 gam và 24,8 gam.
D.11,2 gam và 20 gam.
9. Chỉ dùng thêm một hóa chất, hãy phân biệt các chất trong những dãy sau và viết phương trình hóa học để giải thích.
a) Các kim loại: Al, Mg, Ca, Na.
b) Các dung dịch: NaCl, $CaCl_{2}$, $AlCl_{3}$.
c) Các chất bột: CaO, MgO, $Al_{2}O_{3}$.
10. Viết phương trình hóa học để giải thích các hiện tượng xảy ra khi
a) cho dung dịch $NH_{3}$ dư vào dung dịch $AlCl_{3}$.
b) cho từ từ dung dịch NaOH đến dư vào dung dịch $AlCl_{3}$.
c) cho từ từ dung dịch $Al_{2}(SO_{4})_{3}$ vào dung dịch NaOH và ngược lại.
d) sục từ từ đến dư khí $CO_{2}$ vào dung dịch $NaAlO_{2}$.
e) cho từ từ đến dư dung dịch HCl vào dung dịch $NaAlO_{2}$.
11. Hỗn hợp X gồm hai kim loại K và Al có khối lượng 10,5 gam. Hòa tan hoàn toàn hỗn hợp X trong nước được dung dịch A. Thêm từ từ dung dịch HCl 1M vào dung dịch A thấy lúc đầu không có kết tủa, khi thêm được 100 ml dung dịch HCl 1 M thì bắt đầu có kết tủa. Tính thành phần % số mol của các kim loại trong X.
HƯỚNG DẪN GIẢI
1. Chọn D
- Phương trình hóa học của phản ứng:
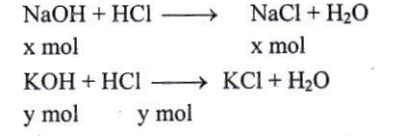
-Từ phương trình trên và dữ kiện để bài ta có:
$\left\{\begin{matrix} 40x+56y=3,04\\ 58,5x+74,5y=4,15 \end{matrix}\right.$
- Giải ra, ta được: x = 0,02 mol; y = 0,04 mol
⇒ $m_{NaOH}$ = 0,02.40 = 0,8g; $m_{KOH}$ = 0,04.56 = 2,24g.
2. Chọn C. Ta có: $n_{CO_{2}}$ = $\large \frac{6,72}{22,4}$ = 0,3 mol
⇒ 1 $\leq$ $\large \frac{n_{CO_{2}}}{n_{Ca(OH)_{2}}}$ = $\large \frac{0,3}{0,25}$ = 1,2 $\leq$ 2
- Phương trình hóa học của phản ứng:
.png)
⇒ $\left\{\begin{matrix} x+2y=0,3\\ x+y=0,25 \end{matrix}\right.$
⇒ y = 0,05 mol; x = 0,2 mol.
- Khối lượng kết tủa thu được là: $m_{CaCO_{3}}$ = 0,2.100 = 20g.
3. Chọn C.
4. - Phương trình hóa học của phản ứng:
$MgCO_{3}+2HCl\rightarrow MgCl_{2}+CO_{2}$.png) + $H_{2}O$
+ $H_{2}O$
$BaCO_{3}+2HCl\rightarrow BaCl_{2}+CO_{2}$.png) + $H_{2}O$
+ $H_{2}O$
$CO_{2}+ Ca(OH)_{2}\rightarrow CaCO_{3}$.png) + $H_{2}O$
+ $H_{2}O$
- Theo các phương trình trên, để lượng kết tủa lớn nhất thì:
$n_{CO_{2}}$ = $n_{MgCO_{3}}$ + $n_{BaCO_{3}}$ = 0,2 mol
⇒ $\large \frac{28,1.a}{100.84}$ + $\large \frac{28,1.(100-a)}{100.197}$ = 0,2 ⇒ a = 29,89%.
5. Chọn B.
6. Chọn C.
- Phương trình hóa học của phản ứng:
.png)
- Tổng số mol $CO_{2}$ là: $n_{CO_{2}}$ = 0,03 + 0,02 + 0,02 = 0,07 mol
7. Chọn D.
8. Chọn B
- Phương trình hóa học của phản ứng:
.png)
$Al_{2}O_{3}+2NaOH\rightarrow 2NaAlO_{2}+H_{2}O$
⇒ $m_{Al}$ = 27.0,4 = 10,8g
$m_{Al_{2}O_{3}}$ = 31,2 - 10,8 = 20,4g
9. a) Dùng $H_{2}O$ để phân biệt được 4 kim loại: Al, Mg, Ca, Na:
$2Na+2H_{2}O\rightarrow 2NaOH+H_{2}$.png)
$Ca+2H_{2}O\rightarrow Ca(OH)_{2}$ (ít tan) + $H_{2}$.png)
- Dùng dung dịch NaOH ở trên để phân biệt Al và Mg (huyền phù: không tan):
$2Al+2NaOH+2H_{2}O\rightarrow 2NaAlO_{2}+3H_{2}$
Mg + NaOH → không phản ứng.
Như vậy ta phân biệt được 4 kim loại trên.
b) Dung dịch NaOH để phân biệt các dung dịch NaCl, $CaCl_{2}$, $AlCl_{3}$:
Cho từ từ dung dịch NaOH vào các mẫu thử chứa các dung dịch trên, ta thấy có những hiện tượng sau:
- Mẫu thử có kết tủa trắng và tan dần trong NaOH dư, chất trong mẫu thử $AlCl_{3}$:
$AlCl_{3}+3NaOH\rightarrow Al(OH)_{3}$.png) + $3NaCl$
+ $3NaCl$
$Al(OH)_{3}+NaOH\rightarrow NaAlO_{2}+2H_{2}O$
- Mẫu thử có vẩn đục và không tan trong NaOH dư là $CaCl_{2}$:
$CaCl_{2}+2NaOH\rightarrow Ca(OH)_{2}$ (vẩn đục) + $2NaCl$
- Mẫu thử không có hiện tượng gì xảy ra là NaCl.
c) Dùng $H_{2}O$ để phân biệt 3 chất bột: CaO, MgO, $Al_{2}O_{3}$.
- Cho $H_{2}O$ và 3 mẫu thử chứa chất bột trên, chỉ có CaO tan:
$CaO+H_{2}O\rightarrow Ca(OH)_{2}$
- Dùng $Ca(OH)_{2}$ cho vào 2 bột còn lại, bột nào tan là $Al_{2}O_{3}$, không tan là MgO.
$Al_{2}O_{3}+Ca(OH)_{2}\rightarrow Ca(AlO_{2})_{2}+H_{2}O$
10. - Phương trình hóa học của phản ứng:
a) Cho dung dịch $NH_{3}$ dư vào dung dịch $AlCl_{3}$
$AlCl_{3}+3NH_{3}+3H_{2}O\rightarrow Al(OH)_{3}$.png) + $3NH_{4}Cl$
+ $3NH_{4}Cl$
- Dung dịch $NH_{3}$ là bazơ nên không hòa tan được $Al(OH)_{3}$ ⇒ $Al(OH)_{3}$ kết tủa hoàn toàn.
b) Cho từ từ dung dịch NaOH đến dư vào dung dịch $AlCl_{3}$
$AlCl_{3}+3NaOH\rightarrow Al(OH)_{3}$.png) + $3NaCl$
+ $3NaCl$
$Al(OH)_{3}+NaOH$ (dư) $\rightarrow NaAlO_{2}+2H_{2}O$
c) Cho từ từ dung dịch $Al_{2}(SO_{4})_{3}$ vào dung dịch NaOH
Khi cho từ từ dung dịch $Al_{2}(SO_{4})_{3}$ vào dung dịch NaOH có kết tủa nếu lắc nhẹ thì kết tủa tan ngay vì $Al(OH)_{3}$ kết tủa trong dung dịch NaOH, nếu cho dung dịch $Al_{2}(SO_{4})_{3}$ dư thì kết tủa $Al(OH)_{3}$ không tan.
$Al_{2}(SO_{4})_{3}+6NaOH\rightarrow 2Al(OH)_{3}+3Na_{2}SO_{4}$
- Nếu cho dung dịch NaOH vào dung dịch $Al_{2}(SO_{4})_{3}$ thì xuất hiện kết tủa và kết tủa chỉ tan khi cho dư NaOH hay $n_{NaOH}$ > $n_{Al_{2}(SO_{4})_{3}}$
d) Sục khí $CO_{2}$ vào dung dịch $NaAlO_{2}$ thì xuất hiện kết tủa trắng $Al(OH)_{3}$.
$CO_{2}+NaAlO_{2}+2H_{2}O\rightarrow Al(OH)_{3}$.png) + $NaHCO_{3}$
+ $NaHCO_{3}$
e) Cho từ từ dung dịch HCl vào dung dịch $NaAlO_{2}$ thì xuất hiện kết tủa, nếu dùng dung dịch HCl dư thì kết tủa tan vì:
$H_{2}O+HCl+NaAlO_{2}\rightarrow Al(OH)_{3}$.png) + $NaCl$
+ $NaCl$
$Al(OH)_{3}+3HCl$ (dư) $\rightarrow AlCl_{3}+3H_{2}O$
11. - Phương trình hóa học của phản ứng:
.png)
- Do X tan hết nên Al hết, KOH dư. Khi thêm HCl vào thì ban đầu chưa có kết tủa do:
KOH (dư) + HCl → KCl + $H_{2}O$
- Khi HCl trung hòa hết KOH dư thì tác dụng với $KAlO_{2}$ để xuất hiện kết tủa:
$KAlO_{2}+HCl+H_{2}O\rightarrow Al(OH)_{3}$.png) + $KCl$
+ $KCl$
⇒ Để trung hòa KOH dư cần 100 ml dung dịch HCl 1M.
Ta có: $n_{HCl}$ = $n_{KOH}$ dư sau phản ứng 2 = x - y = 0,1
Mặt khác: 39x + 27y = 10,5
⇒ x= 0,2 mol; y = 0,1 mol.
⇒ %$n_{K}$ = $\large \frac{0,2}{0,3}$.100% = 66,67%.
%$n_{Al}$ = 100% - 66,67% = 33,33%.
