Chương 7: SẮT VÀ MỘT SỐ KIM LOẠI QUAN TRỌNG
CHÌA KHÓA GIẢI NHANH CÁC DẠNG BÀI TẬP KHÓ
Từ các kiến thức đã trình bày ở phần bài giảng và các dạng bài tập đã giải ở phần lời giải chi tiết các câu hỏi và bài tập cơ bản, phần các câu hỏi và bài tập mở rộng, nâng cao chúng ta nhận thấy: Để giải nhanh các dạng bài tập khó ở chương này cần chú ý:
1.Các tính chất hóa học chung của sắt và một số kim loại quan trọng như Cr, Cu, Ni, Zn, Pb, Sn...
- Các kim loại đứng trước H trong dãy điện hóa như Cr, Fe, Ni, Zn, Sn khi tác dụng với dung dịch $H_{2}SO_{4}$ loãng sẽ giải phóng hiđro và tạo ra muối (II) còn các kim loại đứng sau như Pb, Ag... không phản ứng với dung dịch $H_{2}SO_{4}$ loãng.
- Các kim loại như Cu, Zn, Ni, Sn tan trong $HNO_{3}$, $H_{2}SO_{4}$ đặc (Pb chỉ tan trong $H_{2}SO_{4}$ đặc, nóng) còn Cr, Fe không tan.
- Các kim loại trên đều phản ứng được với $HNO_{3}$ loãng hay đặc nóng.
- Các kim loại như Cr, Zn, Sn, Pb phản ứng được với dung dịch kiềm nóng (KOH, NaOH) giải phóng khí $H_{2}$.
2. Các tính chất hóa học riêng của các kim loại có nhiều số oxi hóa như Fe, Cr và hợp chất của nó
- Fe và Cr khi phản ứng với $Cl_{2}$ sẽ tạo thành muối clorua sắt (III) và clorua crom (III).
- Khi nung $Fe(OH)_{2}$ và $Cr(OH)_{2}$ trong không khí sẽ thu được $Fe_{2}O_{3}$ và $Cr_{2}O_{3}$ còn khi nung không có không khí thì sẽ thu được FeO và CrO.
- Crom (III) oxit và crom (III) hiđroxit đều có tính lưỡng tính:
Thí dụ:
$Cr(OH)_{3}+NaOH\rightarrow Na[Cr(OH)_{4}]$
$Cr(OH)_{3}+3HCl\rightarrow CrCl_{3}+3H_{2}O$
BÀI TẬP LUYỆN TẬP
1. Điền công thức hóa học của chất vào những chỗ trống và lập các phương trình hóa học sau:
a) Fe + $H_{2}SO_{4}$ (đặc) $\overset{t^{0}}{\rightarrow}SO_{2}$ + ...
b) Fe + $HNO_{3}$ (đặc) $\overset{t^{0}}{\rightarrow}NO_{2}$ + ...
c) Fe + $HNO_{3}$ (loãng) → NO + ...
d) $FeS+HNO_{3}\rightarrow NO+Fe_{2}(SO_{4})_{3}$ + ...
2. Bằng phương pháp hóa học, hãy phân biệt 3 mẫu hợp kim sau: Al - Fe, Al - Cu và Cu - Fe.
3. Một hỗn hợp bột gồm Al, Fe, Cu. Hãy trình bày phương pháp hóa học để tách riêng từng kim loại từ hỗn hợp đó. Viết phương trình hóa học của các phản ứng.
4. Cho một ít bột sắt nguyên chất tác dụng hết với dung dịch $H_{2}SO_{4}$ loãng thu được 560 ml một chất khí ở đktc. Nếu cho một lượng gấp đôi bột sắt nói trên tác dụng hết với dung dịch $CuSO_{4}$ thì thu được một chất rắn. Tính khối lượng bột sắt đã dùng trong 2 trường hợp trên và khối lượng chất rắn thu được.
5. Biết 2,3 gam hỗn hợp gồm MgO, CuO và FeO tác dụng vừa đủ với 100 ml dung dịch $H_{2}SO_{4}$ 0,2 M. Khối lượng muối thu được là
A.3,6 gam.
B.3,7 gam.
C.3,8 gam.
D.3,9 gam.
6. Nguyên tử của nguyên tố X có tổng số hạt proton, nơtron và electron là 82, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 22. Nguyên tố X là
A.sắt.
B.brom.
C.photpho.
D.crom.
7. Hoàn thành phương trình hóa học của các phản ứng trong dãy chuyển đổi sau:
$Cu\overset{(1)}{\rightarrow}CuS\overset{(2)}{\rightarrow}Cu(NO_{3})_{2}\overset{(3)}{\rightarrow}Cu(OH)_{2}\overset{(4)}{\rightarrow}CuCl_{2}\overset{(5)}{\rightarrow}Cu$
8. Cho 100g hợp kim gồm có Fe, Cr và Al tác dụng với lượng dư dung dịch NaOH thu được 6,72 lít khí. Lấy phần rắn không tan cho tác dụng với lượng dư dung dịch HCl (khi không có không khí) thu được 38,08 lít khí. Các thể tích khí đều đo ở đktc. Xác định thành phần % khối lượng của hợp kim.
9. Hỗn hợp X gồm Cu và Fe, trong đó Cu chiếm 43,24% khối lượng. Cho 14,8 gam X tác dụng hết với dung dịch HCl thấy có V lít khí (đktc) bay ra. Giá trị của V là
A.1,12 lít.
B.2,24 lít.
C.4,48 lít.
D.3,36 lít.
10. Khử m gam bột CuO bằng khí $H_{2}$ ở nhiệt độ cao thu được hỗn hợp chất rắn X. Để hòa tan hết X cần vừa đủ 1 lít dung dịch $HNO_{3}$ 1M thu được 4,48 lít khí NO duy nhất (đktc). Hiệu suất của phản ứng khử CuO là
A.70%.
B.75%.
C.80%.
D.85%.
11. Nhúng thanh sắt vào dung dịch $CuSO_{4}$, sau một thời gian lấy thanh sắt ra rửa sạch, sấy khô thấy khối lượng tăng 1,2 gam. Khối lượng Cu đã bám vào thanh sắt là
A.9,3 gam.
B.9,4 gam.
C.9,5 gam.
D.9,6 gam.
12. Cho Cu tác dụng với dung dịch hỗn hợp gồm $NaNO_{3}$ và $H_{2}SO_{4}$ loãng sẽ giải phóng khí nào sau đây?
A.$NO_{2}$.
B.NO.
C.$N_{2}O$.
D.$NH_{3}$.
HƯỚNG DẪN GIẢI
1. Các phương trình hóa học của phản ứng:
a) $2Fe+6H_{2}SO_{4}$ (đặc) $\overset{t^{0}}{\rightarrow}Fe_{2}(SO_{4})_{3}+3SO_{2}$.png) + $6H_{2}O$
+ $6H_{2}O$
b) $Fe+6HNO_{3}$ (đặc) $\overset{t^{0}}{\rightarrow}Fe(NO_{3})_{3}+3NO_{2}+3H_{2}O$
c) $Fe+4HNO_{3}$ (loãng) $\rightarrow Fe(NO_{3})_{3}+NO+2H_{2}O$
d) $4FeS+12HNO_{3}+2H_{2}SO_{4}\rightarrow 2Fe_{2}(SO_{4})_{3}+12NO+8H_{2}O$
2. - Cho 3 mẫu hợp kim tác dụng với dung dịch NaOH, mẫu hợp kim không có hiện tượng gì xảy ra là Cu-Fe, hai mẫu kia có khí sinh ra là Al-Fe và Al-Cu, do tác dụng với dung dịch NaOH:
$2Al+2NaOH+2H_{2}O\rightarrow 2NaAlO_{2}+3H_{2}$.png)
- Sau đó cho dung dịch HCl vào hai mẫu còn lại, một mẫu sau một thời gian không còn kim loại nào là Al-Fe, còn mẫu kim loại còn lại không tác dụng với Al-Cu.
3. - Cho hỗn hợp tác dụng với dung dịch NaOH, lọc lấy phần không tan, thổi $CO_{2}$ vào nước lọc thu được kết tủa.
$2Al+2NaOH+2H_{2}O\rightarrow 2NaAlO_{2}+3H_{2}$.png)
$CO_{2}+2H_{2}O+NaAlO_{2}\rightarrow Al(OH)_{3}$.png) + $NaHCO_{3}$
+ $NaHCO_{3}$
- Nhiệt phân $Al(OH)_{3}$ rồi điện phân nóng chảy $Al_{2}O_{3}$ ta được Al:
$2Al(OH)_{3}\overset{t^{0}}{\rightarrow}Al_{2}O_{3}+3H_{2}O$
$Al_{2}O_{3}\overset{dpnc}{\rightarrow}2Al+\frac{3}{2}O_{2}$
- Cho hỗn hợp còn lại (Fe, Cu) tác dụng với dung dịch HCl, lọc ta được đồng, điện phân dung dịch nước lọc ta được Fe:
$Fe+2HCl\rightarrow FeCl_{2}+H_{2}$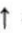
Cu + HCl → không tác dụng
$FeCl_{2}\overset{dpdd}{\rightarrow}Fe+Cl_{2}$
4. - Phương trình hóa học của phản ứng:
.png)
⇒ $m_{Fe}$ = 0,025.56 = 1,4g
.png)
⇒ $m_{Fe}$ (tham gia phản ứng) = 0,05.56 = 2,8 gam
m chất rắn = (0,05.64) - (0,05.56) = 0,4 gam.
5. Chọn D.
- Ta có: $n_{H_{2}SO_{4}}$ = $\large \frac{100.0,2}{1000}$ = 0,02 mol
$MgO+H_{2}SO_{4}\rightarrow MgSO_{4}+H_{2}O$
$CuO+H_{2}SO_{4}\rightarrow CuSO_{4}+H_{2}O$
$FeO+H_{2}SO_{4}\rightarrow FeSO_{4}+H_{2}O$
- Từ các phản ứng trên, ta có: $n_{O}$ = $n_{H_{2}O}$ = $n_{H_{2}SO_{4}}$ = 0,02 mol
⇒ Khối lượng muối thu được: m = 2,3 – 0,02.16 + 0,02.96 = 3,9 gam.
6. Chọn A.
Ta có:
$\left\{\begin{matrix} p+e+n=82\\ p+e-n=22 \end{matrix}\right.$ hay 2p + 2e = 104
p + e = 52
Vì p = e → p = e = 26. Đó là sắt (Fe).
7. Phương trình hóa học của các phản ứng:
(1) $Cu+S\overset{t^{0}}{\rightarrow}CuS$
(2) $3CuS+14HNO_{3}\rightarrow 3Cu(NO_{3})_{2}+3H_{2}SO_{4}+4H_{2}O+8NO$
(3) $Cu(NO_{3})_{2}+2NaOH\rightarrow Cu(OH)_{2}$.png) + $2NaNO_{3}$
+ $2NaNO_{3}$
(4) $Cu(OH)_{2}+2HCl\rightarrow CuCl_{2}+2H_{2}O$
(5) $CuCl_{2}\overset{dpdd}{\rightarrow}Cu+Cl_{2}$
8. Phương trình hóa học của phản ứng:
.png)
⇒ $m_{Fe+Cr}$ = 100 – 0,2.27 = 96,4g
.png)
Vì khi không có không khí, $CrCl_{2}$ không bị oxi hóa thành $CrCl_{3}$.
⇒ $\left\{\begin{matrix} 56x+52y=94,6\\ x+y=1,7 \end{matrix}\right.$
⇒ x = 1,55 mol; y = 0,15 mol
⇒ $m_{Fe}$ = 1,55.56 = 86,8g; $m_{Cr}$ = 0,15.52 = 7,8g.
⇒ %$m_{Al}$ = 5,4%; $m_{Fe}$ = 86,8%; $m_{Cr}$ = 7,8%.
9. Chọn D.
Ta có: $m_{Cu}$ = $\large \frac{43,24.14,8}{100}$ = 6,4g
$m_{Fe}$ = 14,8 - 6,4 = 8,4g.
⇒ $n_{Fe}$ = $\large \frac{8,4}{56}$ = 0,15 mol
.png)
⇒ $V_{H_{2}}$ = 0,15.22,4 = 3,36 lít.
10.Chọn C.
- Phương trình hóa học của phản ứng:
.png)
⇒ $V_{NO}$ = 0,25.22,4 = 5,6 lít
- Hiệu suất phản ứng: H = $\large \frac{4,48}{5,6}$.100% = 80%.
11.Chọn D.
- Phương trình hóa học của phản ứng:
.png)
⇒ 64x - 56x = 1,2
⇒ x = 0,15 mol
- Khối lượng Cu bám vào thanh sắt là: $m_{Cu}$ = 0,15.64 = 9,6 gam.
12.Chọn D.
