§32. PHẢN ỨNG OXI HÓA - KHỬ
A. KIẾN THỨC CẦN NHỚ
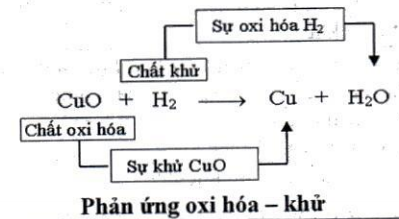
1- Sự khử. Sự oxi hóa
– Sự khử: Là sự tách oxi ra khỏi hợp chất.
- Sự oxi hóa: Là sự tác dụng của oxi với một chất.
2. Chất khử và chất oxi hóa
- Chất khử: Là chất chiếm oxi của chất khác.
- Chất oxi hóa: Là chất nhường oxi cho chất khác.
3. Phản ứng oxi hóa - khử: Là phản ứng hóa học trong đó xảy ra đồng thời sự oxi hóa và sự khử.
B. BÀI GIẢI CHI TIẾT CÁC CÂU HỎI VÀ BÀI TẬP
1.Cho các sơ đồ phản ứng:
.png)
a) Hãy lập các phương trình hóa học của các phản ứng trên.
b) Quá trình nào được gọi là sự khử? Quá trình nào được gọi là sự oxi hóa?
Trong các phản ứng trên, phản ứng nào là phản ứng oxi hóa – khử? Vì sao? Chất nào là chất khử, chất nào là chất oxi hóa?
Trả lời:
a) Các phương trình phản ứng hóa học:
.png)
b) Trong các phản ứng trên thì:
.png)
Những phản ứng trên đều là phản ứng oxi hóa - khử xảy ra đồng thời sự oxi hóa và sự khử.
2. Trong số các loại phản ứng hóa học sau: A.Phản ứng hóa hợp; B.Phản ứng phân hủy; C.Phản ứng oxi hóa - khử. Sự biến đổi hóa học sau đây thuộc loại phản ứng nào:
a) Nung nóng canxi cacbonat?
b) Sắt tác dụng với lưu huỳnh?
c) Khí CO đi qua chì (II) oxit nung nóng?
Trả lời:
Sự biến đổi hóa học các phản ứng sau:
a) Nung nóng canxi cacbonat: Thuộc loại phản ứng B.
b) Sắt tác dụng với lưu huỳnh: Thuộc loại phản ứng A.
c) Khí CO đi qua chì (II) oxit: Thuộc loại phản ứng C.
3. Phản ứng $H_{2}$ khử sắt (II) oxit thuộc loại phản ứng gì? Tính số gam sắt (II) oxit bị khử bởi 2,24 lít khí hiđro (đktc).
Trả lời:
- Số mol hiđro ứng với 2,24 lít khí là: $n_{H_{2}}$ = $\large \frac{2,24}{22,4}$ = 0,1 mol.
- Phản ứng $H_{2}$ khử sắt (II) oxit là phản ứng oxi hóa – khử:
.png)
- Từ phản ứng trên, số mol FeO cần dùng là: x = 0,1mol
- Khối lượng FeO cần dùng là: $m_{FeO}$ = 0,1.72 = 7,2g.
4. Cần điều chế 33,6g sắt bằng cách dùng khí CO khử $Fe_{3}O_{4}$.
a) Viết phương trình phản ứng.
b) Tính khối lượng $Fe_{3}O_{4}$ cần dùng.
c) Tính thể tích khí CO đã dùng (đktc).
Trả lời:
a) Ta có: số mol sắt được điều chế là: $n_{Fe}$ = $\large \frac{33,6}{56}$ = 0,6mol
- Phản ứng điều chế sắt là:
.png)
- Từ phương trình trên ta thấy:
+ Số mol $Fe_{3}O_{4}$ cần dùng là: x = $\large \frac{0,6.1}{3}$ = 0,2mol.
+ Số mol CO cần dùng là: y = $\large \frac{0,6.4}{3}$ = 0,8mol.
b) Khối lượng $Fe_{3}O_{4}$ cần dùng để điều chế 33,6g Fe là:
$m_{Fe_{3}O_{4}}$ = 232.0,2 = 46,4g
c)Thể tích CO cần dùng là: $V_{CO}$ = 0,8.22,4 = 17,92 lít.
5. Người ta dùng khí cacbon oxit để khử đồng (II) oxit.
a) Nếu khử a gam đồng (II) oxit thì thu được bao nhiêu gam đồng?
b) Cho a = 150g, hãy tính kết quả bằng số.
Trả lời:
Phản ứng dùng khí CO để khử CuO là:
.png)
a) Khối lượng Cu thu được là: x = $\large \frac{64.a}{80}$ = 0,8a.
b) Kết quả bằng số với a = 150g là: $m_{Cu}$ = x = 0,8.150 = 120g
6. Khử 12g sắt (III) oxit bằng khí hiđro.
a) Thể tích khí hiđro (đktc) cần dùng là:
A. 5,04 lit.
B. 7,56 lit.
C. 10,08 lit.
D. 8,2 lit.
b) Khối lượng sắt thu được là:
A. 16,8g.
B. 8,4g.
C. 12,6g.
D. 18,6g.
Trả lời:
a) Chọn A.
- Số mol sắt (III) oxit là: $n_{Fe_{2}O_{3}}$ = $\large \frac{12}{160}$ = 0,075mol
- Phương trình phản ứng:
.png)
- Số mol $H_{2}$ cần dùng là:
x = 0,075.3 = 0,225mol; y = 0,075.2 = 0,15mol.
- Thể tích $H_{2}$ cần dùng là: $V_{H_{2}}$ = 0,225.22,4 = 5,04 lít.
b) Chọn B. Khối lượng sắt thu được là: $m_{Fe}$ = 0,15.56 = 8,4g.
7. Người ta điều chế được 24g đồng bằng cách dùng hiđro khử đồng (II) oxit.
a) Khối lượng đồng (II) oxit bị khử là:
A. 15g.
B. 45g.
C. 60g.
D. 30g.
b)Thể tích khí hiđro (đktc) đã dùng là:
A. 8,4 lit.
B. 12,6 lit.
C. 4,2 lit.
D. 16,8 lit.
Trả lời:
a) Chọn D.
- Số mol Cu điều chế được là: $n_{Cu}$ = $\large \frac{24}{64}$ = 0,375mol.
- Phương trình phản ứng:
.png)
– Suy ra: x = 0,375mol ; y = 0,375mol.
- Khối lượng CuO bị khử là: $m_{CuO}$ = 0,375.80 = 30g.
b) Chọn A. Thể tích khí $H_{2}$ đã dùng là: $V_{H_{2}}$ = 0,375.22,4 = 8,4 lít.
