21. Ba nguyên tố có cấu hình electron nguyên tử như sau :
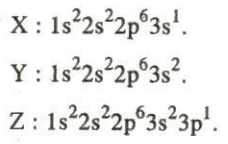
Hiđroxit của X, Y, Z xếp theo thứ tự tính bazơ tăng dần là
.png)
22. Cấu hình electron hoá trị của nguyên tử Y là $3d^{5}4s^{1}$. Số hiệu nguyên tử của nguyên tố Y là
A. 20.
B. 22.
C. 24.
D.26.
23. Để phân loại các nguyên tố hoá học thành kim loại và phi kim, người ta dựa vào
A. hoá trị.
B. nguyên tử khối.
C. cấu tạo nguyên tử.
D. số proton trong hạt nhân.
24. Nguyên tử của những nguyên tố hoá học trong cùng nhóm A có cùng
A. nguyên tử khối.
B. số lớp electron.
C. cấu hình electron lớp ngoài cùng.
D. bán kính nguyên tử.
25. Tính kim loại của một nguyên tố theo quan điểm hoá học được thể hiện bằng
A. độ âm điện nhỏ.
B. khả năng nhường electron của nguyên tử.
C. khả năng phản ứng với phi kim.
D. cấu trúc mạng tinh thể kim loại.
26. Cation $X^{3+}$ có cấu hình electron lớp ngoài cùng là $3s^{2}3p^{6}$. Vị trí của nguyên tố X trong bảng tuần hoàn là
A. chu kì 3, nhóm IIIA, là nguyên tố kim loại.
B. chu kì 4, nhóm IIIB, là nguyên tố kim loại.
C. chu kì 3, nhóm VIA, là nguyên tố phi kim.
D. chu kì 4, nhóm IVB, là nguyên tố kim loại.
27. Những tính chất nào sau đây đặc trưng cho kim loại chuyển tiếp ?
A. Ion trong dung dịch không có màu, có nhiều số oxi hoá dương.
B. Ion trong dung dịch không có màu, có nhiều số oxi hoá âm.
C. Ion trong dung dịch thường có màu, có nhiều số oxi hóa dương.
D. Ion trong dung dịch có màu, có nhiều số oxi hoá âm.
28. Dựa trên cơ sở nào để sắp xếp các nguyên tố vào cùng một nhóm?
A. Chúng có kích thước nguyên tử như nhau.
B. Chúng có mức năng lượng obitan nguyên tử lớp ngoài cùng như nhau.
C. Chúng có cấu hình electron hoá trị giống nhau.
D. Chúng có độ âm điện như nhau.
29. Trong một chu kì, theo chiều điện tích hạt nhân nguyên tử tăng dần
A. tính kim loại của các nguyên tố tăng dần.
B. tính phi kim của các nguyên tố giảm dần.
C. hoá trị cao nhất của các nguyên tố đối với oxi tăng dần.
D. hoá trị cao nhất của nguyên tố phi kim đối với hiđro là không đổi.
30. Nguyên tử của bốn nguyên tố X, Y, Z, T có cấu hình electron như sau :
.png)
Phát biểu nào sau đây sai ?
A. Cả bốn nguyên tố đểu ở chu kì 3.
B. Các nguyên tố X, Y là kim loại ; Z, T là phi kim.
C. Cả bốn nguyên tố đều ở nhóm A.
D. Một trong bốn nguyên tố là khí hiếm.
31. Trong một chu kì, số oxi hoá của các nguyên tố phi kim trong hợp chất khí với hiđro biến đổi
A. từ -1 đến –8 (theo chiều từ trái sang phải).
B. từ -8 đến 0 (theo chiều từ phải sang trái).
C. từ -4 đến -1 (theo chiều từ trái sang phải).
D. từ -1 đến -4 (theo chiều từ trái sang phải).
32. Vị trí (nhóm, chu kì) của nguyên tố có cấu hình electron nguyên tử .png) là
là
A. chu kì 3, nhóm IIA.
B. chu kì 1, nhóm IIIA.
C. chu kì 4, nhóm IIA.
D. chu kì 2, nhóm IVA.
33. Các nguyên tố hoá học trong một nhóm A có tính chất hoá học giống nhau vì:
A. tạo thành các nhóm tự nhiên của các nguyên tố.
B. tạo thành các oxit có công thức giống nhau.
C. có hoá trị như nhau.
D. nguyên tử có số electron ở lớp ngoài cùng như nhau.
34. Những tính chất nào sau đây của nguyên tố hoá học biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử ?
a) Nguyên tử khối.
b) Số hiệu nguyên tử.
c) Bán kính nguyên tử.
d) Tính kim loại của các nguyên tố.
e) Tính phi kim của các nguyên tố.
f) Khối lượng riêng.
g) Độ dẫn điện.
h) Năng lượng ion hoá.
i) Màu sắc.
k) Số oxi hoá trong các hợp chất điển hình.
l) Hoạt tính hoá học.
m) Tính chất hoá học của các hiđroxit.
n) Cấu trúc của lớp electron ngoài cùng trong nguyên tử.
A. c, d, e, h, k, m, n.
B. a, b, c, d, e, f, g.
C. b, c, d, e, f, g, h.
D. d, e, f, g, h, i, k.
35. Trong nhóm A, theo chiều tăng của điện tích hạt nhân nguyên tử
A. tính kim loại của các nguyên tố giảm dần, tính phi kim của các nguyên tố tăng dần.
B. tính kim loại của các nguyên tố tăng dần, tính phi kim của các nguyên tố giảm dần.
C. tính phi kim của các nguyên tố tăng dần, tính kim loại của các nguyên tố giảm dần.
D. tính kim loại và phi kim của các nguyên tố là không biến đổi.
36. Cho các nguyên tố M (Z = 11), X (Z = 17), Y (Z = 9) và R (Z = 19). Độ âm điện của các nguyên tố tăng dần theo thứ tự :
A. M < X < Y < R.
B. R < M < X < Y.
C. Y < M < X < R.
D. M < X < R < Y.
37. Trong một chu kì, theo chiều tăng của điện tích hạt nhân nguyên tử, độ âm điện của nguyên tử
A. giảm dần.
B. không thay đổi.
C. biến đổi không có quy luật.
D. tăng dần.
38. Trong một nhóm A, theo chiều điện tích hạt nhân nguyên tử tăng dần
A. tính bazơ của các oxit và hiđroxit giảm dần.
B. tính axit của các oxit và hiđroxit tăng dần.
C. tính bazơ của các oxit và hiđroxit tăng dần.
D. tính axit của các oxit và hiđroxit không đổi.
39. Những nguyên tố trong một nhóm A có tính chất sau :
A. Điện tích hạt nhân tăng thì tính kim loại tăng dần, tính phi kim tăng dần.
B. Điện tích hạt nhân tăng thì tính kim loại tăng dần, tính phi kim giảm dần.
C. Điện tích hạt nhân tăng thì tính kim loại giảm dần, tính phi kim giảm dần.
D. Điện tích hạt nhân tăng thì tính kim loại giảm dần, tính phi kim tăng dần.
40. Chu kì 4 bắt đầu từ nguyên tố có số hiệu nguyên tử Z = 19 và kết thúc chu kì là nguyên tố có số hiệu nguyên tử Z = 36.
Nguyên tố nào sau đây là kim loại chuyển tiếp?
A. Z = 20
B. Z = 26
C. Z = 33
D. Z = 35
HƯỚNG DẪN TRẢ LỜI
21. Đáp án đúng là C.
Hướng dẫn trả lời :
Từ cấu hình electron nguyên tử của ba nguyên tố ta biết :
- Chúng đều ở chu kì 3 (có 3 lớp electron).
- Nguyên tố X ở nhóm IA ; Y ở nhóm IIA ; Z ở nhóm IIIA.
Công thức phân tử hiđroxit của chúng là XOH, $Y(OH)_{2}$, $Z(OH)_{3}$
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính bazơ của hiđroxit giảm dần. Do đó:
$Z(OH)_{3}$ < $Y(OH)_{2}$ < XOH.
22. Đáp án đúng là C.
Hướng dẫn trả lời :
Nguyên tố Y có 4 lớp electron → Ở chu kì 4.
Cấu hình electron nguyên tử là : [Ar]$3d^{5}4s^{1}$.
(Cấu hình của nguyên tử Y có đặc điểm là vội bão hoà nửa phân lớp 3d).
Số electron của nguyên tử Y là 18 + 5 + 1 = 24.
Số proton của hạt nhân nguyên tử Y là 24. Do đó, số hiệu nguyên tử Z của nguyên tử Y là 24.
23. Đáp án đúng là C.
24. Đáp án đúng là C.
25. Đáp án đúng là B.
26. Đáp án đúng là B.
Hướng dẫn trả lời:
- Cation $X^{3+}$ được tạo thành do:
X → $X^{3+}$ + 3e
- Cấu hình electron $3s^{2}3p^{6}$ là cấu hình electron lớp ngoài cùng của khí hiếm Ar (cuối chu kì 3).
Vậy cấu hình electron của nguyên tử X là : [Ar]$3d^{1}4s^{2}$
Từ cấu hình electron nguyên tử ta biết :
- Nguyên tố X ở chu kì 4 (nguyên tử có 4 lớp electron).
- Nguyên tố X là nguyên tố d, có 3 electron hoá trị. Do đó, nguyên tố X ở nhóm IIIB – Đó là nguyên tố kim loại.
27. Đáp án đúng là C.
28. Đáp án đúng là C.
29. Đáp án đúng là C.
30. Phát biểu sai là B.
31. Đáp án đúng là C.
32. Đáp án đúng là A.
33. Đáp án đúng là D.
34. Đáp án đúng là A.
35. Đáp án đúng là B.
36. Đáp án đúng là B.
Hướng dẫn trả lời :
Viết cấu hình electron của các nguyên tử sẽ biết: M(Z = 11) ở chu kì 3, nhóm IA (kim loại kiềm), X(Z = 17) ở chu kì 3, nhóm VIIA (halogen), Y(Z = 9) ở chu kì 2, nhóm VIIA và R (Z = 19) ở chu kì 4, nhóm IA.
Từ đó biết độ âm điện tăng dần theo dãy:
R < M < X < Y
37. Đáp án đúng là D.
38. Đáp án đúng là C.
39. Đáp án đúng là B.
40. Đáp án đúng là B.
Hướng dẫn trả lời:
Chu kì 4 gồm:
- Hai nguyên tố s ($4s^{1}$, $4s^{2}$): Z = 19 và Z = 20.
- Mười nguyên tử d (kim loại chuyển tiếp):
Từ nguyên tố có Z = 21 đến Z = 30.
- Sáu nguyên tố p: Từ nguyên tố Z = 31 đến Z = 36.
Vậy nguyên tố Z = 26 là nguyên tố kim loại chuyển tiếp.
