§2. DÃY ĐIỆN HOÁ CỦA KIM LOẠI. SỰ ĐIỆN PHÂN
I. DÃY ĐIỆN HOÁ CỦA KIM LOẠI
1. Khái niệm về cặp oxi hoá - khử
Mỗi chất oxi hoá và chất khử của cùng một nguyên tố kim loại tạo nên cặp oxi hoá - khử.
Ví dụ: 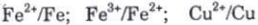
2. Pin điện hoá
a) Thí nghiệm
Nhúng một lá Cu vào dung dịch .png) đựng trong một cốc thủy tinh, nhúng một lá Zn vào dung dịch
đựng trong một cốc thủy tinh, nhúng một lá Zn vào dung dịch .png) đựng trong một cốc thủy tinh khác. Nối hai dung dịch bằng một ống thủy tinh hình chữ U đựng dung dịch
đựng trong một cốc thủy tinh khác. Nối hai dung dịch bằng một ống thủy tinh hình chữ U đựng dung dịch .png) .
.
Nối hai lá kim loại bằng một dây dẫn điện và mắc nối tiếp với một vôn kế. Xuất hiện dòng điện một chiều đi từ cực Cu (điện cực +) đến điện cực Zn (điện cực -). Thiết bị này gọi là pin điện hoá.
b) Kết luận
Những quá trình oxi hoá và khử xảy ra trên bề mặt các điện cực của pin điện hoá được viết bằng phương trình ion rút gọn sau:
.png)
Như vậy, trong pin điện hoá kẽm - đồng xảy ra phản ứng giữa cặp oxi hoá - khử .png) và
và .png) . Trong đó,
. Trong đó, .png) là chất oxi hoá mạnh hơn đã oxi hoá chất khử mạnh hơn là Zn thành chất oxi hoá yếu hơn là
là chất oxi hoá mạnh hơn đã oxi hoá chất khử mạnh hơn là Zn thành chất oxi hoá yếu hơn là .png) và
và .png) bị khử thành chất khử yếu hơn theo sơ đồ:
bị khử thành chất khử yếu hơn theo sơ đồ:
.png)
c) Nhận xét
- Trong quá trình phóng điện, nồng độ .png) trong dung dịch giảm dần, nồng độ
trong dung dịch giảm dần, nồng độ .png) tăng dần. Phản ứng oxi hoá - khử trong pin điện hoá sinh ra dòng điện một chiều.
tăng dần. Phản ứng oxi hoá - khử trong pin điện hoá sinh ra dòng điện một chiều.
- Suất điện động U của pin điện hoá phụ thuộc vào: bản chất cặp oxi hoá - khử của kim loại, nồng độ dung dịch muối và nhiệt độ.
3. Thế điện cực chuẩn của kim loại
Không thể xác định được thế điện cực tuyệt đối của mỗi cặp oxi hoá - khử, nên ta phải dùng một điện cực làm chuẩn để so sánh. Đó là điện cực hiđro chuẩn.
a) Thế điện cực hiđro chuẩn
Người ta quy ước thế điện cực hiđro chuẩn của cặp oxi hoá - khử .png) là 0,00V và
là 0,00V và .png) = 0,00V.
= 0,00V.
b) Thế điện cực chuẩn của kim loại
Để xác định thế điện cực chuẩn của kim loại nào đó, ta thiết lập một pin điện hoá gồm điện cực chuẩn của kim loại ở bên phải với điện cực hiđro chuẩn ở bên trái. Vôn kế cho biết hiệu số điện thế lớn nhất giữa hai điện cực chuẩn. Nếu điện cực kim loại là cực âm của pin thì thế điện cực chuẩn của kim loại có giá trị âm. Ngược lại, nếu điện cực kim loại là cực dương của pin thì thế điện cực chuẩn của kim loại có giá trị dương.
Ví dụ 1: Xác định thế điện chuẩn của cặp .png) . Lắp thiết bị pin điện hoá Zn -
. Lắp thiết bị pin điện hoá Zn - .png) . Hiđro là cực dương (+), kẽm là cực âm (-). Khi pin hoạt động ở các điện cực xảy ra như sau (Tên gọi và dấu điện cực trong pin điện hoá được quy ước):
. Hiđro là cực dương (+), kẽm là cực âm (-). Khi pin hoạt động ở các điện cực xảy ra như sau (Tên gọi và dấu điện cực trong pin điện hoá được quy ước):
- Cực (-) (có tên là anot) điện cực mà ở đây xảy ra sự oxi hoá, nguồn electron được sinh ra ở đây:
.png) .
.
- Cực (+) (có tên là catot) điện cực mà ở đây xảy ra sự khử, các electron bị tiêu hao ở đây:
.png)
Phương trình oxi hoá - khử trong pin điện hoá:
.png)
Vôn kế là -0,76V, do đó .png)
Ví dụ 2: Xác định thế điện cực chuẩn của cặp .png) . Lắp pin điện hoá
. Lắp pin điện hoá .png) . Bạc là cực (+), hiđro là cực (-). Khi pin hoạt động:
. Bạc là cực (+), hiđro là cực (-). Khi pin hoạt động:
- Cực (-): .png)
- Cực (+): .png)
Phương trình oxi hoá - khử trong pin điện hoá:
.png)
Vôn kế là +0,80V. Do đó .png)
4. Dãy điện hoá chuẩn của kim loại và ý nghĩa
a) Dãy điện hoá chuẩn của kim loại
- Để so sánh tính chất những cặp oxi hoá - khử ta phải dựa vào dãy điện hoá chuẩn của kim loại. Dãy điện hoá chuẩn của kim loại là dãy những cặp oxi hoá - khử của kim loại được sắp xếp theo chiều điện thế cực chuẩn của các cặp oxi hoá - khử tăng dần. Dưới đây là dãy điện hoá chuẩn của một số kim loại thông dụng:
.png)
* Nhận xét. (Áp dụng cho phản ứng xảy ra trong môi trường nước):
- Thế điện cực chuẩn .png) càng lớn thì tính oxi hoá của
càng lớn thì tính oxi hoá của .png) càng mạnh và tính khử của kim loại M càng yếu.
càng mạnh và tính khử của kim loại M càng yếu.
- Thế điện cực chuẩn .png) càng nhỏ thì tính oxi hoá của
càng nhỏ thì tính oxi hoá của .png) càng yếu và tính khử của kim loại M càng mạnh.
càng yếu và tính khử của kim loại M càng mạnh.
b) Ý nghĩa của dãy điện hoá chuẩn của kim loại
(1) Dãy điện hoá chuẩn của kim loại cho phép ta dự đoán chiều của phản ứng giữa 2 cặp oxi hoá - khử:
- Kim loại của cặp oxi hoá - khử có thế điện cực nhỏ hơn đẩy được ion kim loại của cặp oxi hoá - khử có thế điện cực lớn hơn ra khỏi dung dịch muối. Nói cách khác, cation kim loại trong cặp oxi hoá - khử có thế điện cực lớn có thể oxi hoá được kim loại trong cặp có thế điện cực nhỏ hơn (trừ những kim loại tác dụng với nước).
Ví dụ: Xét phản ứng giữa 2 cặp oxi hoá - khử:
.png)
Cation .png) oxi hoá Ni thành cation
oxi hoá Ni thành cation .png) và cation
và cation .png) bị khử thành Pb.
bị khử thành Pb.
.png)
- Trong hai cặp oxi hoá - khử, thì cặp nào có tính oxi hoá mạnh hơn (.png) dương hơn) sẽ nhận electron và ngược lại. Như vậy, chênh lệch
dương hơn) sẽ nhận electron và ngược lại. Như vậy, chênh lệch .png) càng lớn thì phản ứng xảy ra càng dễ. Nói cách khác, kim loại càng xa nhau phản ứng oxi hoá - khử giữa chúng xảy ra dễ dàng.
càng lớn thì phản ứng xảy ra càng dễ. Nói cách khác, kim loại càng xa nhau phản ứng oxi hoá - khử giữa chúng xảy ra dễ dàng.
(2) Kim loại trong cặp oxi hoá - khử có thế điện cực nhỏ hơn 0,00V đẩy được .png) ra khỏi dung dịch axit. Nói cách khác, cation
ra khỏi dung dịch axit. Nói cách khác, cation .png) trong cặp
trong cặp .png) có thể oxi hoá được kim loại trong cặp oxi hoá - khử có thế điện cực nhỏ hơn (thế điện cực âm). Ví dụ, phản ứng giữa hai cặp oxi hoá - khử:
có thể oxi hoá được kim loại trong cặp oxi hoá - khử có thế điện cực nhỏ hơn (thế điện cực âm). Ví dụ, phản ứng giữa hai cặp oxi hoá - khử:
.png)
(3) Xác định suất điện động chuẩn của pin điện hoá.
.png)
• .png) có giá trị càng lớn (càng dương), phản ứng xảy ra dễ dàng.
có giá trị càng lớn (càng dương), phản ứng xảy ra dễ dàng.
• .png) > 0 phản ứng có thể tự xảy ra.
> 0 phản ứng có thể tự xảy ra.
Ví dụ:
• Suất điện động chuẩn của pin điện hóa .png) bằng:
bằng:
.png) = 0,34V – (-0,76V) = 1,10 (V)
= 0,34V – (-0,76V) = 1,10 (V)
• Suất điện động chuẩn của pin điện hóa .png) bằng:
bằng:
.png) = -0,13V - (-0,76V) = 0,63 (V)
= -0,13V - (-0,76V) = 0,63 (V)
Lưu ý: Điện cực âm là điện cực ở đó cation kim loại nhận electron hoàn toàn không phụ thuộc vào giá trị đại số của .png) .
.
II. SỰ ĐIỆN PHÂN
1. Một số khái niệm về sự điện phân
a) Định nghĩa
Sự điện phân là quá trình oxi hoá khử xảy ra ở bề mặt các điện cực khi cho dòng điện một chiều qua hợp chất nóng chảy hoặc dung dịch chất điện li.
b) Thiết bị điện phân
- Anot được nối với cực dương của nguồn điện một chiều, ở đây xảy ra sự oxi hoá.
- Catot được nối với cực âm của nguồn điện một chiều, ở đây xảy ra sự khử.
2. Sự điện phân các chất điện li
a) Phản ứng oxi hoá - khử xảy ra ở điện cực khi điện phân
- Cation (ion dương) về catot (điện cực âm), tại đó cation nhận electron để tạo ra sản phẩm (chất oxi hoá).
- Anion (ion âm) về anot (điện cực dương), tại đó anion nhường electron để tạo ra sản phẩm (chất khử).
Phản ứng oxi hoá - khử xảy ra ở điện cực là giai đoạn quan trọng nhất, cần xác định rõ ion nào ưu tiên nhận hoặc nhường electron và tạo sản phẩm là gì?
b) Sự oxi hoá - khử trên bề mặt điện cực
(1) Điện phân các chất nóng chảy (muối, .png) , bazơ, ...) dùng để điều chế các kim loại hoạt động hoá học mạnh như Na, K, Mg, Ca, Al.
, bazơ, ...) dùng để điều chế các kim loại hoạt động hoá học mạnh như Na, K, Mg, Ca, Al.
Ở catot ion dương kim loại nhận electron.
Ở anot ion âm nhường electron.
(2) Điện phân dung dịch chất điện phân.
- Khi điện phân dung dịch chất điện phân có nhiều chất oxi hoá và chất khử thì sẽ xảy ra oxi hoá - khử lần lượt ở các điện cực theo thứ tự ưu tiên.
- Để viết phương trình điện phân, cần xét riêng các quá trình xảy ra ở catot và ở anot.
Thứ tự nhận electron
- Ở cực âm có các ion .png) và cation kim loại. Cation kim loại nhận e theo thứ tự tính oxi hoá mạnh hơn thì bị điện phân trước:
và cation kim loại. Cation kim loại nhận e theo thứ tự tính oxi hoá mạnh hơn thì bị điện phân trước:
.png)
Sản phẩm tạo thành: .png)
Riêng với ion .png) :
:
của axit: .png)
của nước: .png)
- Ở cực dương có các anion và nhường electron theo thứ tự:
.png)
Sản phẩm tạo thành: .png)
.png)
Riêng với .png) :
:
của bazơ: .png)
của .png) :
: .png)
- Chú ý tới vật liệu làm anot, anot không bị hoà tan, thí dụ graphit, platin.
c) Hiện tượng anot tan
Ví dụ điện phân dung dịch .png) , anot bằng Cu.
, anot bằng Cu.
• Ở anot (cực +). Trên bề mặt anot có mặt đồng thời .png) và Cu (cấu tạo nên anot):
và Cu (cấu tạo nên anot): .png)
.png) oxi hoá Cu thành CuO tan trong dung dịch khi điện phân
oxi hoá Cu thành CuO tan trong dung dịch khi điện phân .png) ,
, .png) tan vào dung dịch điện phân
tan vào dung dịch điện phân .png) và di chuyển đến catot.
và di chuyển đến catot.
• Ở catot (cực -). Trên bề mặt catot có mặt đồng thời các ion .png) . Trong đó
. Trong đó .png) có tính oxi hoá mạnh nhất, do vậy
có tính oxi hoá mạnh nhất, do vậy .png) bị khử thành đồng bám vào catot. Như vậy anot cứ bị tan dần, nồng độ ion
bị khử thành đồng bám vào catot. Như vậy anot cứ bị tan dần, nồng độ ion .png) trong dung dịch điện li là không thay đổi. Có thể coi sự điện phân là sự chuyển tải đơn giản kim loại Cu từ anot sang catot.
trong dung dịch điện li là không thay đổi. Có thể coi sự điện phân là sự chuyển tải đơn giản kim loại Cu từ anot sang catot.
d) Tính lượng sản phẩm điện phân thu được
Tính khối lượng các chất thu được ở điện cực, áp dụng công thức Faraday:
.png)
Trong đó:
m: khối lượng chất thu được ở điện cực (gam)
A: khối lượng mol nguyên tử của chất thu được ở điện cực
n: số electron mà nguyên tử hoặc ion đã cho hoặc nhận
I: cường độ dòng điện (ampe)
t: thời gian điện phân (giây)
Chú ý: Số mol chất thu được ở điện cực:
.png)
.png) : Đương lượng gam của chất được giải phóng ở điện cực.
: Đương lượng gam của chất được giải phóng ở điện cực.
Lưu ý:
• Điện phân nóng chảy chất điện phân
- Xác định phản ứng oxi hoá - khử xảy ra ở điện cực.
- Tương tác của sản phẩm điện phân thu được với điện cực.
• Điện phân dung dịch điện phân trong nước
- Xác định các cation, anion nhận và nhường electron theo thứ tự ưu tiên.
- Phản ứng phụ: Xét phản ứng có thể xảy ra giữa từng cặp:
+ Chất tạo thành ở điện cực
+ Chất tan trong dung dịch
+ Chất dùng làm điện cực.
Nhận xét: Khi điện phân các dung dịch:
- Hiđroxit của kim loại hoạt động hoá học mạnh (KOH, NaOH, .png) )
)
- Axit có oxi .png)
- Muối .png)
Thực tế là điện phân .png) để cho
để cho .png) (ở catot) và
(ở catot) và .png) (ở anot).
(ở anot).
- Khi điện phân dung dịch NaCl, đề bài cho chỉ thu được một chất khí ở điện cực, chứng tỏ điện phân không có màng ngăn tạo nước Javel. Chất khí thu được ở điện cực là khí hiđro.
- Khi đang điện phân, không xảy ra phản ứng giữa axit trong dung dịch với bất kì kim loại nào bám trên catot. Nếu ngắt điện, phản ứng xảy ra bình thường.
• Điện phân dung dịch hỗn hợp các chất
- Xác định cation, anion nhận electron và nhường electron theo thứ tự ưu tiên.
- Viết phương trình điện phân, sản phẩm thu được theo thời gian điện phân.
e) Ứng dụng của sự điện phân
Sự điện phân có nhiều ứng dụng trong công nghiệp.
(1) Điều chế kim loại
- Những kim loại có thế điện cực chuẩn rất nhỏ như các kim loại kiềm (K, Na, ...) được điều chế bằng cách điện phân những hợp chất ion của chúng ở dạng nóng chảy.
- Một số kim loại dù có thế điện cực chuẩn âm nhưng vẫn có thể điều chế bằng cách điện phân dung dịch muối của chúng.
(2) Điều chế một số phi kim: .png)
(3) Điều chế một số hợp chất: .png) , NaOH, nước Javel,
, NaOH, nước Javel, .png) , ...
, ...
(4) Tinh chế một số kim loại: Cu, Pb, Fe, Ag, Au, ...
(5) Mạ điện: mạ kẽm, niken, bạc, vàng, ...
