§7. SƠ LƯỢC VỀ MỘT SỐ KIM LOẠI KHÁC
I. SƠ LƯỢC VỀ BẠC, VÀNG
1. Bạc (Ag)
a) Vị trí trong bảng tuần hoàn
• Ag là nguyên tố kim loại chuyển tiếp, thuộc nhóm IB, số hiệu nguyên tử là 47, chu kì 5 trong bảng tuần hoàn.
• Trong các hợp chất, Ag có số oxi hoá +1, ngoài ra còn có số oxi hoá +2, +3.
b) Tính chất
• Bạc dẫn điện, dẫn nhiệt tốt, là kim loại nặng.
• Bạc có tính khử yếu nhưng ion 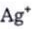 có tính oxi hoá mạnh.
có tính oxi hoá mạnh.
• Bạc không bị oxi hoá trong không khí dù ở nhiệt độ cao.
• Bạc không tác dụng với HCl, .png) loãng nhưng tác dụng với
loãng nhưng tác dụng với .png) đặc nóng.
đặc nóng.
.png)
• Bạc có màu đen khi tiếp xúc với nước có chứa hiđro sunfua.
.png)
c) Ứng dụng và trạng thái tự nhiên
• Chế tạo đồ trang sức, chế tạo một số linh kiện trong kĩ thuật vô tuyến. Ion .png) có khả năng sát trùng.
có khả năng sát trùng.
• Phần lớn Ag ở trạng thái hợp chất.
2. Vàng (Au)
a) Vị trí trong bảng tuần hoàn
• Au là nguyên tố kim loại chuyển tiếp, thuộc nhóm IB, chu kì 6, số hiệu nguyên tử là 79 trong bảng tuần hoàn.
• Trong các hợp chất, Au có số oxi hoá +3, ngoài ra còn có số oxi hoá +1.
b) Tính chất
• Vàng có tính dẫn điện và dẫn nhiệt tốt chỉ kém bạc và đồng.
• Vàng có tính khử yếu không bị oxi hoá trong không khí dù ở nhiệt độ cao và không bị hoà tan trong .png) .
.
• Vàng bị hoà tan trong nước cường toan (1V .png) và 3V HCl đặc).
và 3V HCl đặc).
.png)
• Vàng bị hoà tan trong NaCN tạo ion phức .png)
c) Ứng dụng và trạng thái tự nhiên
• Vàng được dùng làm đồ trang sức, mạ vàng cho những vật trang trí.
• Phần lớn, Au để chế tạo hợp kim Au - Cu, Au - Ni.
• Trong tự nhiên hầu như vàng ở trạng thái tự do, một lượng nhỏ ở dạng sunfua.
• Khai thác vàng bằng 1 trong 2 phương pháp:
- Phương pháp đất: Dùng dòng nước để tách các hạt vàng, nước cuốn các hạt cát có khối lượng riêng nhỏ hơn, còn lại hạt vàng.
- Phương pháp hoá học (thủy luyện): Dùng dung dịch natri xianua hoà tan các hạt vàng tạo ion phức .png) . Sau đó dùng kim loại hoạt động hoá học mạnh, như Zn để khử ion phức vàng thành vàng tự do.
. Sau đó dùng kim loại hoạt động hoá học mạnh, như Zn để khử ion phức vàng thành vàng tự do.
.png)
II. SƠ LƯỢC VỀ NIKEN, KẼM
1. Niken (Ni)
a) Vị trí trong bảng tuần hoàn
• Ni là nguyên tố kim loại chuyển tiếp, thuộc nhóm VIIIB, chu kì 4, số hiệu nguyên tử là 28 trong bảng tuần hoàn
• Trong các hợp chất, Ni có số oxi hoá +2, ngoài ra còn có số oxi hoá +3.
b) Tính chất
• Ni có tính khử yếu hơn sắt, trên bề mặt niken có lớp oxit bảo vệ nên niken không tác dụng với oxi, nước.
• Niken dễ tan trong dung dịch .png) đặc nóng.
đặc nóng.
c) Ứng dụng và trạng thái tự nhiên
• Phần lớn niken dùng để chế tạo hợp kim. Ni có tác dụng chống ăn mòn, chịu nhiệt độ cao.
• Một phần nhỏ được dùng làm chất xúc tác, chế tạo ắcquy Fe - Ni.
2. Kẽm (Zn)
a) Vị trí trong bảng tuần hoàn
• Kẽm là nguyên tố kim loại chuyển tiếp, thuộc nhóm IIB, chu kì 4, số hiệu nguyên tử là 30 trong bảng tuần hoàn.
• Trong các hợp chất, Zn có số oxi hoá +2.
b) Tính chất
• Zn là kim loại hoạt động hoá học mạnh, tác dụng được với nhiều phi kim, dung dịch bazơ, dung dịch axit, dung dịch muối.
• Trên bề mặt kẽm có lớp oxit nên kẽm không bị oxi hoá trong không khí, nước.
c) Ứng dụng và trạng thái tự nhiên
• Phần lớn dùng để bảo vệ bề mặt các vật bằng sắt, thép chống ăn mòn.
• Zn được dùng để chế tạo hợp kim, pin điện hoá.
• Chỉ tồn tại ở quặng .png) , ZnS.
, ZnS.
d) Điều chế Zn
Quá trình sản xuất Zn từ quặng có 2 công đoạn:
- Đốt quặng để chuyển hoá thành oxit:
.png)
- Khử ZnO thành Zn bằng phương pháp điện phân hoặc nhiệt luyện.
+ Phương pháp điện phân (80% sản lượng Zn trên thế giới được sản xuất theo phương pháp điện phân)
.png)
+ Phương pháp nhiệt luyện:
.png)
III. SƠ LƯỢC VỀ THIẾC, CHÌ
1. Thiếc (Sn)
a) Vị trí trong bảng tuần hoàn
• Thiếc là kim loại thuộc nhóm IVA, chu kì 5, có số hiệu nguyên tử 50 trong bảng tuần hoàn.
• Trong các hợp chất, Sn có số oxi hoá +2 và +4.
b) Tính chất
• Thiếc là kim loại có tính khử yếu hơn kẽm và niken.
- Trong không khí ở nhiệt độ thường, Sn không bị oxi hoá. Ở nhiệt độ cao Sn bị oxi hoá thành .png) .
.
- Sn tác dụng chậm với HCl và .png) loãng, với
loãng, với .png) loãng tạo muối Sn (II) và không giải phóng
loãng tạo muối Sn (II) và không giải phóng .png) .
.
- Sn với .png) ,
, .png) đặc tạo muối Sn (IV).
đặc tạo muối Sn (IV).
• Thiếc bị hoà tan trong kiềm đặc.
.png)
c) Ứng dụng và trạng thái tự nhiên
• Thiếc được dùng để tráng lên các vật bằng sắt thép, các vỏ hộp đựng thực phẩm... có tác dụng chống ăn mòn.
• Thiếc dùng để chế tạo các hợp kim.
• Thiếc tồn tại ở dạng hợp chất .png) .
.
• Thiếc được điều chế:
.png)
2. Chì (Pb)
a) Vị trí trong bảng tuần hoàn
• Chì là kim loại thuộc nhóm IVA, chu kì 6, có số hiệu nguyên tử 82 trong bảng tuần hoàn.
• Trong các hợp chất, Pb có số oxi hoá +2 và +4, số oxi hoá +2 là phổ biến và bền.
b) Tính chất
• Chì có tính khử yếu.
• Chì không tác dụng với các dung dịch HCl và .png) loãng do các muối chì không tan bao bọc kim loại. Chì tan nhanh trong
loãng do các muối chì không tan bao bọc kim loại. Chì tan nhanh trong .png) đặc nóng tạo muối tan
đặc nóng tạo muối tan .png) . Chì tan dễ dàng trong dung dịch
. Chì tan dễ dàng trong dung dịch .png) , tan chậm trong
, tan chậm trong .png) đặc.
đặc.
• Chì tan chậm trong kiềm nóng.
.png)
c) Ứng dụng và trạng thái tự nhiên
• Chì được dùng rộng rãi trong công nghiệp điện: làm vỏ dây cáp, điện cực trong ắcquy...
• Chì được dùng để chế tạo các thiết bị sản xuất axit sunfuric, như tháp hấp thụ.
• Chì được dùng để chế tạo các hợp kim không mài mòn các trục quay...
• Thiếc tồn tại ở dạng PbS, .png) .
.
• Sản xuất chì:
.png)
