§3. SỰ ĂN MÒN KIM LOẠI
I. SỰ ĂN MÒN KIM LOẠI
1. Định nghĩa.
Sự ăn mòn kim loại là sự phá hủy kim loại hoặc hợp kim do tác dụng của chất trong môi trường.
- Kim loại bị ăn mòn là kim loại bị oxi hoá thành ion dương, do đó sẽ mất đi tính chất vật lí, hoá học của kim loại.
- Căn cứ vào môi trường và cơ chế của sự ăn mòn kim loại, người ta phân thành hai loại chính: ăn mòn hoá học và ăn mòn điện hoá học.
2. So sánh sự ăn mòn hoá học và sự ăn mòn điện hoá học
a) Sự ăn mòn hoá học
- Điều kiện xảy ra ăn mòn: Thường xảy ra ở những thiết bị lò đốt hoặc những thiết bị thường xuyên phải tiếp xúc với hơi nước và khí oxi,...
- Cơ chế của sự ăn mòn: Thiết bị bằng Fe tiếp xúc với hơi nước, khí oxi thường xảy ra phản ứng:
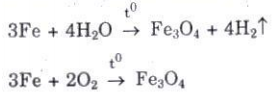
- Bản chất của sự ăn mòn: Là quá trình oxi hoá - khử, trong đó các electron của kim loại được chuyển trực tiếp đến các chất trong môi trường, ăn mòn xảy ra chậm.
b) Sự ăn mòn điện hoá học
- Điều kiện xảy ra ăn mòn:
+ Các điện cực phải khác nhau, có thể là cặp hai kim loại khác nhau hoặc cặp kim loại - phi kim hoặc cặp kim loại - hợp chất hoá học (như .png) ). Trong đó kim loại có thế điện cực chuẩn nhỏ hơn sẽ là cực âm.
). Trong đó kim loại có thế điện cực chuẩn nhỏ hơn sẽ là cực âm.
+ Các điện cực phải tiếp xúc trực tiếp hoặc gián tiếp với nhau qua dây dẫn, các điện cực phải tiếp xúc với dung dịch chất điện li.
- Cơ chế của sự ăn mòn:
+ Sự ăn mòn điện hoá một vật bằng gang (hợp kim Fe - C) (hoặc thép) trong môi trường không khí ẩm có hoà tan khí .png) ... sẽ tạo ra một lớp dung dịch điện li phủ bên ngoài kim loại.
... sẽ tạo ra một lớp dung dịch điện li phủ bên ngoài kim loại.
+ Tinh thể Fe (cực âm), tinh thể C là cực dương.
Ở cực dương: xảy ra phản ứng khử:
.png)
Ở cực âm: xảy ra phản ứng oxi hoá:
.png)
Những .png) tan vào dung dịch chứa oxi →
tan vào dung dịch chứa oxi → .png) và cuối cùng tạo gỉ sắt có thành phần
và cuối cùng tạo gỉ sắt có thành phần .png) .
.
- Bản chất của sự ăn mòn: Là sự ăn mòn kim loại do tác dụng của dung dịch chất điện li và tạo nên dòng điện. Ăn mòn điện hoá xảy ra nhanh hơn ăn mòn hoá học.
II. CHỐNG ĂN MÒN KIM LOẠI
Có nhiều phương pháp bảo vệ kim loại chống ăn mòn. Phổ biến hơn cả là phương pháp bảo vệ bề mặt và bảo vệ điện hoá.
1. Bảo vệ bề mặt
Bảo vệ bề mặt là phủ lên bề mặt kim loại một lớp sơn, dầu mỡ, chất dẻo hoặc tráng, mạ bằng một kim loại khác. Lớp bảo vệ bề mặt kim loại bền vững với môi trường.
2. Bảo vệ điện hoá
Bảo vệ điện hoá là dùng một kim loại làm "vật hi sinh" để bảo vệ vật liệu kim loại. Ví dụ để bảo vệ vỏ tàu bằng thép, người ta gắn các lá kẽm vào phía ngoài vỏ tàu ở phần chìm trong nước biển. Phần vỏ tàu bằng thép là cực dương, các lá kẽm là cực âm.
- Ở cực âm: Zn bị oxi hoá:
.png)
- Ở cực dương: .png) bị khử:
bị khử:
.png)
Kết quả là vỏ tàu biển được bảo vệ, Zn là "vật hi sinh", nó bị ăn mòn.
