PHẦN I. CÁC ĐỊNH LUẬT VÀ CÔNG THỨC DÙNG GIẢI TOÁN HÓA HỌC
1. Định luật bảo toàn khối lượng:
Tổng khối lượng các chất tham gia phản ứng bằng tổng khối lượng các chất thu được sau phản ứng.
Xét phản ứng A + B → C + D
Ta có : $m_{A}$ + $m_{B}$ = $m_{C}$ + $m_{D}$ + (A, B còn dư)
2. Định luật thành phần không đổi:
Một hợp chất hóa học dù điều chế theo cách nào cũng luôn luôn có một thành phần định tính và định lượng xác định.
3. Định luật Avogađro:
Các thể tích bằng nhau của bất kỳ chất khí nào đo ở cùng điều kiện nhiệt độ và áp suất đều chứa cùng một số phân tử.
$A_{A}$ = $V_{B}$ ⇔ $n_{A}n_{B}$
A, B là 2 khí , đo cùng điều kiện.
4. Các công thức tính số mol (n):
$\large n_{A}=\frac{m_{A}}{M_{A}}$
$m_{A}$: Khối lượng bất kì của chất A.
$M_{A}$: Khối lượng mol chất A.
.png)
N = 6,023.$10^{23}$ (Số Avogađro)
.png)
$V_{A}$: Thể tích khi A, đo ở điều kiện tiêu chuẩn.
$n_{khi A}$ = $\large \frac{P.V}{R.T}$
P: Áp suất khí ở $t^{0}C$ (atm)
V: Thể tích khí ở $t^{0}C$ (lít)
T: Nhiệt độ tuyệt đối °K, T = $t^{0}C$ + 273
R: 0,082 (Hằng số khí lý tưởng)
* Vận dụng phương trình Menđeleep Claperon.
PV = nRT cho trường hợp có hai hệ thống khí A, B khác nhau:
- Nếu cùng V, T thì P tỉ lệ với n.
.png)
- Nếu cùng P, T thì V tỉ lệ với n.
.png)
- Nếu cùng V thì:
.png)
* Áp suất khí chứa trong ống nghiệm úp trên chậu nước ($P_{A}$)
- Nếu mực nước trong ống cao hơn ngoài chậu h(mm).
.png)
- Nếu mực nước trong và ngoài ống nghiệm ngang nhau:
.png)
5. Khối lượng mol trung bình của một hỗn hợp ($\bar{M}$)
$\large \bar{M}=\frac{m_{hh}}{n_{hh}}=\frac{M_{1}.n_{1}+M_{2}.n_{2}+...}{n_{1}+n_{2}}=\frac{M_{1}.V_{1}+M_{2}.V_{2}+...}{V_{1}+V_{2}+...}$
$m_{hh}$: Khối lượng hỗn hợp.
$n_{hh}$: Số mol hỗn hợp.
$M_{1}$, $n_{1}$: Khối lượng mol, số mol của khí thứ 1.
$M_{2}$, $V_{2}$: Khối lượng mol, thể tích của khí thứ 2.
6. Tỉ khối hơi của chất A đối với chất B (Đo cùng điều kiện V, T, P):
$d_{A/B}$ = $\large \frac{M_{A}}{M_{B}}$ = $\large \frac{m_{A}}{m_{B}}$ = $\large \frac{\bar{M}_{hhA}}{\bar{M}_{hhB}}$
7. Khối lượng riêng:
D = m / v
8. Các công thức giải toán:
* Nồng độ phần trăm:
C% = $\large \frac{m_{ct}}{m_{dd}}$.100%
$m_{ct}$: Khối lượng chất tan.
$m_{dd}$: Khối lượng dung dịch.
$m_{dd}$ = $m_{ct}$ + m dung môi
* Nồng độ mol/lít:
$C_{M}$ = $\large \frac{n_{A}(mol)}{V_{dd}(lit)}$ = $\large \frac{m_{A}/M_{A}}{V_{dd}}$
* Quan hệ giữa C% và $C_{M}$:
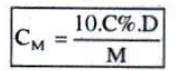
* Nồng độ % thể tích (Độ rượu):
.png) = $\large \frac{V_{ct}}{V_{dd}}$.100%
= $\large \frac{V_{ct}}{V_{dd}}$.100%
$V_{ct}$, $V_{dd}$: Thể tích chất tan, thể tích dung dịch.
* Độ tan T của một chất là số gam chất đó khi tan trong 100g dung môi nước tạo ra được dung dịch bão hòa ở một nhiệt độ xác định.
.png)
* Độ điện li $\alpha$ (alpha): $\alpha$ = $\large \frac{n}{n_{0}}$
n: Số phân tử phân li (hay nồng độ mol chất điện li bị phân li).
$n_{0}$: Số phân tử hòa tan (hay nồng độ mol chất điện li ban đầu).
* pH của dung dịch:
pH = - lg[$H^{+}$]
9. Hằng số cân bằng của phản ứng thuận nghịch:
aA + bB .png) cC + dD
cC + dD
$\large K_{cb}=\frac{[C]^{c}.[D]^{d}}{[A]^{a}.[B]^{b}}$
10. Tính khối lượng chất giải phóng ở điện cực, khi điện phân:
$\large m=\frac{1}{96500}.\frac{A}{n}.I.t$
hoặc $\large m=\frac{A}{n}.\frac{It}{F}$
m: Khối lượng chất thoát ra ở điện cực (gam).
A: Khối lượng mol chất đó.
n: Hóa trị hay số mol electron trao đổi.
I: Cường độ dòng điện (ampe).
t: Thời gian điện phân (giây).
F: 96500 (số Farađay).
