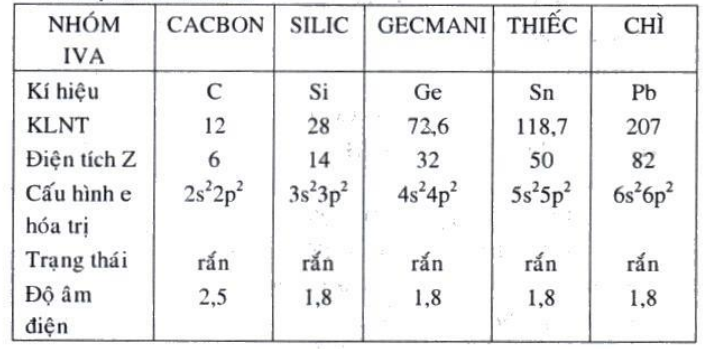
§4.CACBON – SILIC (NHÓM IV A)
A. Một số tính chất:
* Dạng thù hình.
- Cacbon có 3 dạng thù hình: Kim cương (rất cứng), than chì (dẫn điện mềm), cacbon vô định hình (than, mồ hóng) có khả năng hấp thụ tốt. Mới phát hiện gần đây $C_{60}$, dạng trái banh (hình cầu).
- Silic có thể ở dạng tinh thể (màu xám, dòn, hoạt tính thấp) hay ở dạng vô định hình (bột nâu, khá hoạt động).
B. HÓA TÍNH CỦA C VÀ Si:
1. Với đơn chất:
* Kim loại (ở nhiệt độ cao > nhiệt độ nóng chảy).
$Ca+2C\overset{t^{0}cao}{\rightarrow}CaC_{2}$ (canxi cacbua)
$2Mg+Si\overset{t^{0}cao}{\rightarrow}Mg_{2}Si$ (Magiê Silixua)
* Hiđro:
$C+2H_{2}\overset{Ni,500^{0}C}{\rightarrow}CH_{4}$ (Mêtan)
$Si+2H_{2}\overset{Ni,500^{0}C}{\rightarrow}SiH_{4}$ (Silan)
* Oxi:
.png)
$C+CO_{2}\rightarrow 2CO$
$Si+O_{2}\overset{400-600^{0}C}{\rightarrow}SiO_{2}$
* Với nhau:
$Si+C\overset{2000^{0}C}{\rightarrow}SiC$
2. Với hợp chất:
* Với nước:
$H_{2}O+C\overset{t^{0}cao}{\rightarrow}CO+H_{2}$
Hay: $2H_{2}O+C\rightarrow CO_{2}+2H_{2}$
* Với axit:
$C+2H_{2}SO_{4}$ (đun nóng) $\rightarrow CO_{2}+2SO_{2}+2H_{2}O$
$C+4HNO_{3}$ (đun nóng) $\rightarrow CO_{2}+4NO_{2}+2H_{2}O$
Si không tác dụng với axit ở đk thường.
* Với bazơ: chỉ Si tác dụng.
$Si+2KOH+H_{2}O\overset{t^{0}}{\rightarrow}K_{2}SiO_{3}+2H_{2}$
* C là chất khử tương đối mạnh ở nhiệt độ cao:
$CO_{2}+C\overset{t^{0}}{\rightarrow}2CO$
Hoặc: $CuO+C\overset{t^{0}}{\rightarrow}Cu+CO$
$CaO+3C\overset{t^{0}}{\rightarrow}CaC_{2}+CO$.png)
$C+4KNO_{3}\overset{t^{0}}{\rightarrow}CO_{2}+2K_{2}O+4NO_{2}$
C. HỢP CHẤT OXIT CỦA CACBON
1. Cacbonoxit CO: Khí không màu, không mùi, rất độc.
a. Là chất khử mạnh.
* $CuO+CO\overset{t^{0}}{\rightarrow}Cu+CO_{2}$
* $Fe_{2}O_{3}+3CO\rightarrow 2Fe+3CO_{2}$ (qua 3 giai đoạn)
$Fe_{2}O_{3}\overset{CO,t^{0}}{\rightarrow}Fe_{3}O_{4}\overset{CO,t^{0}}{\rightarrow}FeO\overset{CO,t^{0}}{\rightarrow}Fe$
* $CO+H_{2}O+PdCl_{2}\rightarrow Pd$.png) + 2HCl + $CO_{2}$
+ 2HCl + $CO_{2}$.png) (*)
(*)
- Lưu ý:
(*) Dùng để phát hiện CO (dù ít), làm sẫm dung dịch $PdCl_{2}$.
* $2CO+O_{2}$.png) $2CO_{2}$ + 135Kcal (bốc cháy)
$2CO_{2}$ + 135Kcal (bốc cháy)
b. Phản ứng kết hợp:
$CO+Cl_{2}\rightarrow COCl_{2}$ (phosgen)
$3CO+Cr\rightarrow Cr(CO)_{3}$ Cacbonyl crôm
$t^{0}$ > 120°C
c. Điều chế khí than:
* Khí than khô:
$\left\{\begin{matrix} C+O_{2}\overset{t^{0}}{\rightarrow}CO_{2}+Q\\ CO_{2}+C\overset{t^{0}}{\rightarrow}2CO-Q \end{matrix}\right.$
* Khí than ướt :
$\left\{\begin{matrix} C+O_{2}\overset{t^{0}}{\rightarrow}CO_{2}+Q\\ C+H_{2}O\overset{t^{0}}{\rightarrow}CO+H_{2}-Q \end{matrix}\right.$
* Đặc biệt: $CO+NaOH\overset{150^{0}-200^{0}C}{\rightarrow}HCOONa$
2. Khí cacbonic $CO_{2}$
* Khí không màu, hóa lỏng khi nén đến 60 atm, làm lạnh tạo tuyết cacbonic (nước đá khô).
* Là oxit axit tác dụng với bazơ và oxit bazơ.
$CaO+CO_{2}\rightarrow CaCO_{3}$
$CO_{2}+Ca(OH)_{2}\rightarrow CaCO_{3}$.png) + $H_{2}O$
+ $H_{2}O$
$2CO_{2}+Ca(OH)_{2}\rightarrow Ca(HCO_{3})_{2}$
* Bị nhiệt phân hủy ở $t^{0}$ cao:
.png)
* Tác dụng với chất khử mạnh ở $t^{0}$ cao:
$CO_{2}+2Mg\overset{t^{0}}{\rightarrow}2MgO+C$
$CO_{2}+C\overset{t^{0}}{\rightarrow}2CO$
$CO_{2}+H_{2}\overset{t^{0}}{\rightarrow}CO+H_{2}O$
3. Axit cacbonic và muối cacbonat:
a. $H_{2}CO_{3}$ là axit yếu, không bền (chỉ làm quì hơi hồng), chỉ tác dụng với bazơ mạnh.
b. Muối cacbonat (trung tính và axit).
* Muối cacbonat trung hòa của kim loại kiềm đều bền với nhiệt, các muối cacbonat khác bị phân hủy khi đun nóng.
$MgCO_{3}\overset{t^{0}}{\rightarrow}MgO+CO_{2}$
* Muối cacbonat axit dễ bị phân hủy:
$2NaHCO_{3}\overset{t^{0}}{\rightarrow}Na_{2}CO_{3}+CO_{2}+H_{2}O$
* Trung hòa axit:
$2HCl+K_{2}CO_{3}\rightarrow 2KCl+H_{2}O+CO_{2}$.png)
$HCl+KHCO_{3}\rightarrow KCl+H_{2}O+CO_{2}$.png)
* Bị thủy phân tạo dung dịch có tính kiềm.
$Na_{2}CO_{3}+H_{2}O\rightarrow NaHCO_{3}+NaOH$
$NaHCO_{3}+H_{2}O\rightarrow NaOH+CO_{2}$.png) + $H_{2}O$
+ $H_{2}O$
* Chú ý: $NaHCO_{3}$ là muối tan, tan ít hơn $Na_{2}CO_{3}$ và kết tủa trong dung dịch $NH_{4}Cl$ bão hòa:
$NaCl+NH_{4}HCO_{3}\rightarrow NaHCO_{3}$ (dung dịch bão hòa) + $NH_{4}Cl$
D. HỢP CHẤT CỦA Si
I. Silic đioxit $SiO_{2}$:
Chất rắn không màu, có trong thạch anh, cát trắng.
* Không tan và không tác dụng với nước, axit (trừ axit flohiđric).
$SiO_{2}+4HF\rightarrow SiF_{4}+2H_{2}O$
* Tác dụng với bazơ ở nhiệt độ cao:
$SiO_{2}+2NaOH\overset{t^{0}}{\rightarrow}Na_{2}SiO_{3}+H_{2}O$
II. Silan $SiH_{4}$
Là khí không bền, tự bốc cháy trong không khí
$SiH_{4}+2O_{2}\rightarrow SiO_{2}+2H_{2}O$
III. Axit silicic $H_{2}SiO_{3}$ và muối silicat
1. $H_{2}SiO_{3}$ là axit rất yếu (< $H_{2}CO_{3}$), tạo kết tủa keo trong nước và bị nhiệt phân:
$H_{2}SiO_{3}\overset{800^{0}C}{\rightarrow}SiO_{2}+H_{2}O$
2. Muối silicat:
* Dung dịch đặc của $Na_{2}SiO_{3}$ hay $K_{2}SiO_{3}$ gọi là “thủy tinh lỏng”, dùng tẩm vào vải, gỗ làm cho chúng không cháy, dùng chế tạo keo dán thủy tinh.
NHẬN BIẾT CÁC CHẤT VÔ CƠ (ANION)
.png)
