Chương I. SỰ ĐIỆN LI
BÀI 1: SỰ ĐIỆN LI
1. Các dung dịch axit như HCl, bazơ như NaOH và muối như NaCl dẫn điện được, còn các dung dịch như ancol etylic, saccarozơ, glixerol không dẫn điện là do nguyên nhân gì?
Giải
Các dung dịch HCl, NaOH, NaCl dẫn điện được vì trong dung dịch có sự hiện diện của các ion. Các dung dịch ancol etylic, saccarozơ, glixerol không dẫn điện được vì trong dung dịch không có sự hiện diện của các ion.
2. Sự điện li, chất điện li là gì?
Những loại chất nào là chất điện li? Thế nào là chất điện li mạnh, chất điện li yếu? Lấy ví dụ và viết phương trình điện li của chúng.
Giải
Quá trình phân li các chất trong nước ra ion gọi là sự điện li.
Những chất tan trong nước phân li ra ion gọi là những chất điện li
Axit, bazơ, muối là những chất điện li.
Chất điện li mạnh là các chất khi tan trong nước, các phân tử hòa tan đều phân li ra ion.
Ví dụ: $NH_{4}Cl\rightarrow NH_{4}^{+}+Cl^{-}$
Chất điện li yếu là chất khi tan trong nước, các phân tử hòa tan chỉ phân li một phần ra ion, phần còn lại vẫn tồn tại dưới dạng phân tử trong dung dịch.
Ví dụ: $CH_{3}COOH\rightleftharpoons CH_{3}COO^{-}+H^{+}$
3. Viết phương trình điện li của những chất sau:
a) Các chất điện li mạnh: $Ba(NO_{3})_{2}$ 0,10M; $HNO_{3}$ 0,020M; KOH 0,010M. Tính nồng độ mol của từng ion trong các dung dịch trên.
b) Các chất điện li yếu: HClO, $HNO_{2}$.
Giải
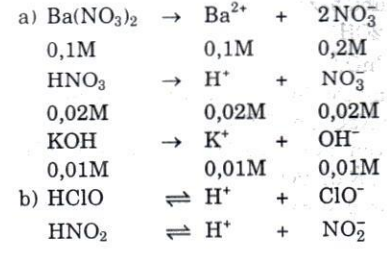
4. Chọn câu trả lời đúng trong các câu sau đây:
Dung dịch chất điện li dẫn điện được là do
A. Sự chuyển dịch của các electron.
B. Sự chuyển dịch của các cation.
C. Sự chuyển dịch của các phân tử hòa tan.
D. Sự chuyển dịch của cả cation và anion.
Giải
Dung dịch chất điện li dẫn điện được là do sự chuyển dịch có hướng của các cation và anion dưới tác dụng của điện trường.
5. Chất nào sau đây không dẫn điện được?
A KCl rắn, khan.
B. $CaCl_{2}$ nóng chảy
C NaOH nóng chảy.
D. HBr hòa tan trong nước.
Giải
KCl khan không dẫn điện.
