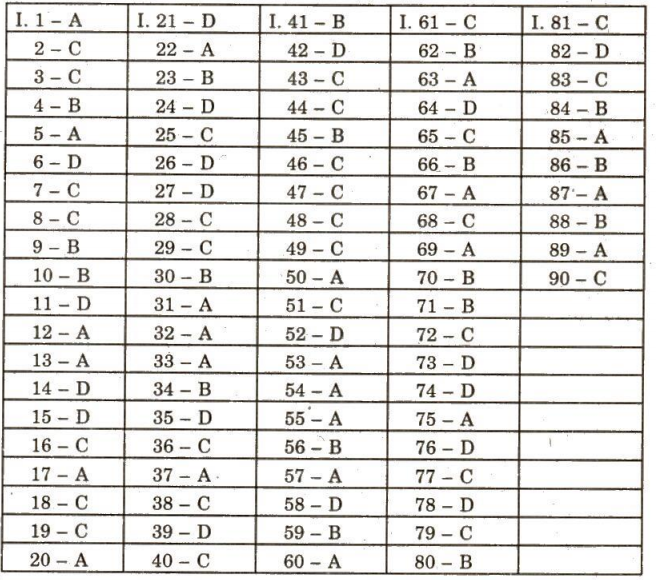
C. ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI
I.1. * Este no đơn chức mạch hở .png) .
.
.png) = 14n + 32 = 44.2 ⇒ n = 4, CTPT
= 14n + 32 = 44.2 ⇒ n = 4, CTPT .png) .
.
* .png) = 8,8 : 88 = 0,1 mol.
= 8,8 : 88 = 0,1 mol.
Dung dịch [NaOH, KOH] = MOH, có:
- .png) = 39,5 x 20% = 7,9 gam =>
= 39,5 x 20% = 7,9 gam => .png) = 0,1975 mol
= 0,1975 mol
= .png) = 39,5 – 7,9 = 31,6 gam.
= 39,5 – 7,9 = 31,6 gam.
* .png)
* Trong phân hơi có .png) và R'OH với:
và R'OH với:
.png) = 36,2 - 31,6 = 4,6 gam
= 36,2 - 31,6 = 4,6 gam
.png) = 0,1 mol
= 0,1 mol
Ta có (R' + 17) 0,1 = 4,6 ⇒ R' = 29, R' là .png)
* CTPT của este X (.png) ) là
) là .png)
I.3. Este no đơn chức mạch hở .png)
.png)
Nhận xét: .png) và
và .png) (hơi) vào dung dịch
(hơi) vào dung dịch .png) dư, cả
dư, cả .png) và
và .png) bị giữ lại trong bình, trong đó có xảy ra phản ứng:
bị giữ lại trong bình, trong đó có xảy ra phản ứng:
.png)
.png)
Ta có: 44a + 18a = 12,4
a = 0,2 mol
Và .png) = 0,2 mol
= 0,2 mol
.png) = 0,2.100 = 20 gam.
= 0,2.100 = 20 gam.
I.5. * n NaOH = 0,3 mol
* .png)
* Nhận xét: Số mol 2 ancol = .png) = 0,2 mol
= 0,2 mol
Suy ra: .png) = 0,3 – 0,2 = 0,1 mol
= 0,3 – 0,2 = 0,1 mol
Số mol .png) = n NaOH = 0,3 mol.
= n NaOH = 0,3 mol.
* Áp dụng định luật BTKL, ta có
.png)
⇒ .png) = (0,3.82 + 7,8 + 0,1.18) - 0,3.40 = 22,2 gam.
= (0,3.82 + 7,8 + 0,1.18) - 0,3.40 = 22,2 gam.
I.17
. .png)
I.19. * Este .png) , có một nối đôi trong phân tử nên là este đơn chức, vậy n= 2.
, có một nối đôi trong phân tử nên là este đơn chức, vậy n= 2.
CTPT: .png) hay RCOOR'
hay RCOOR'
* RCOOR' + NaOH → RCOONa + R'OH
.png)
Suy ra RCOONa là .png)
* CTCT của este là .png)
I.21.
.png)
I.22.
.png)
I.30.
.png)
I.29. .png) là
là .png) ;
; .png) là HCOOH
là HCOOH
X là .png) hay
hay .png) , n = 2.
, n = 2.
I.31.
.png)
I.34.
.png)
I.35.
.png)
I.36.
* Este tạo bởi axit hai chức và ancol đơn chức, có:
.png)
* Este tạo bởi axit đơn chức và ancol hai chức, có:
.png)
I.37. X: .png) , hay
, hay .png) , n = 4
, n = 4
Y: .png) ; Z:
; Z: .png)
I.38. .png) + NaOH → Y duy nhất.
+ NaOH → Y duy nhất.
Suy ra X là este có cấu tạo vòng.
Muối Y + NaOH → rượu .png)
Vậy CTPT của X là:
.png)
* Các phản ứng:
.png)
I.39. Meste = 44.2 = 88
RCOOR' + NaOH → RCOONa + R'OH
Vì khối lượng muối > khối lượng este ⇒ R' < 23 ⇒ R' = .png)
RCOOR' = 88 ⇒ R = 29, R = .png)
Este là .png) .
.
I.40. Để tìm CTPT, ta chuyển .png) về dạng RCOOR'.
về dạng RCOOR'.
n = 8,8 : 88 = 0,1 mol
.png)
Ta có: (R + 44 + 39).0,1 = 9,8
R = 15 ⇒ R = .png)
Vậy este là .png) .
.
Chọn C
I.41. Este no đơn chức .png)
.png)
x = 3
Este .png) có 2 đồng phân.
có 2 đồng phân.
I.42. * .png) = 0,02 mol;
= 0,02 mol; .png) = 0,06 mol;
= 0,06 mol; .png) = 0,08 mol
= 0,08 mol
* Đặt este .png)
.png)
M(este) = 1,76 : 0,02 = 88 g/mol
.png)
* Este .png) = 88
= 88
R = 88 – 44 - 43 = 1, R là H
CTCT của este là .png) .
.
I.43. Chú ý rằng, với este mạch hở trong phản ứng với KOH:
.png)
Chọn C.
I.44. Este RCOOR'
.png)
M(RCOONa) = R + 67 = .png) = 82
= 82
R = 15; R là .png)
M(este)RCOOR' = .png) = 74
= 74
R-COOR' = 15 + 44 + R' = 74 ⇒ R' = 15; R' là .png)
Este là .png) .
.
I.45. .png) = 0,005 mol;
= 0,005 mol; .png) = 0,005 mol
= 0,005 mol
Vậy este là no đơn chức .png)
.png)
Ta có:
.png)
⇒ a = 0,00125 và n = 4
CTPT của este là .png)
Tổng số C (của ancol + axit) = 4
I.47. * Nhận xét
Trong 0,1 este đơn chức .png) có 0,1 mol
có 0,1 mol .png)
.png)
* Áp dụng định luật bảo toàn khối lượng với nguyên tố oxi:
.png)
I.48. Lượng este lí thuyết tính theo axit:
.png)
I.49. .png) = 37.2 = 74, phải là este no đơn chức. Khối lượng muối > khối lượng este, suy ra este phải có dạng
= 37.2 = 74, phải là este no đơn chức. Khối lượng muối > khối lượng este, suy ra este phải có dạng .png) (vì
(vì .png) = 15 < Na = 23).
= 15 < Na = 23).
.png) = 74 ⇒ R = 15
= 74 ⇒ R = 15
Este là .png)
I.50. Meste = 44.2 = 88
Este RCOOR'
RCOOR' + HOH → RCOOH + R'OH (Y)
.png) = 88.0,522 = 46
= 88.0,522 = 46
R'OH = R' + 17 = 46 ⇒ R' = 29 ⇒ R' là .png)
Este .png) = 88
= 88
R = 88 – 29 – 44 = 15 ⇒ R là .png)
Este là .png) (etyl axetat)
(etyl axetat)
I.51. Gọi este .png) . Có b mol
. Có b mol
.png)
.png) và
và .png) đều bị hấp thụ khi tan vào dung dịch NaOH.
đều bị hấp thụ khi tan vào dung dịch NaOH.
Ta có các phương trình liên hệ.
.png)
Giải được bx = 0,2; by = 0,4; bz = 0,2
⇒ x : y : z = 1 : 2 : 1
Công thức nguyên của este .png) .
.
Vì .png) ⇒ este no đơn chức ⇒ n = 2
⇒ este no đơn chức ⇒ n = 2
Vậy CTPT của este là .png) .
.
I.52. * X, Y cùng công thức đơn giản .png) và đơn chức
và đơn chức
Vậy n = 1 hoặc n = 2. Mặt khác .png)
⇒ X là .png) hay H-CHO
hay H-CHO
Y là .png) với 2 đồng phân đơn chức là
với 2 đồng phân đơn chức là .png) .
.
* Liệu Y có tham gia tráng bạc hay không?
Thay X, Y = .png) , phản ứng tráng bạc có thể viết theo sơ đồ đơn giản:
, phản ứng tráng bạc có thể viết theo sơ đồ đơn giản:
.png)
Cần chú ý rằng H-CHO khi bị tráng bạc hoàn toàn thể hiện như anđehit 2 chức.
Suy ra Y có tham gia tráng bạc, Y là .png) . Phản ứng tráng bạc có thể viết theo sơ đồ đơn giản:
. Phản ứng tráng bạc có thể viết theo sơ đồ đơn giản:
.png)
* Ta có :
.png)
=> a = 0,01; b = 0,005
%X = %HCHO = .png)
%Y = .png) = 100 - 50 = 50%
= 100 - 50 = 50%
I.53. * Metyl fomiat .png) và axit axetic
và axit axetic .png) là hai chất đồng phân
là hai chất đồng phân .png) .
.
.png)
* 44.2a + 18.2a = 4,34
a = 0,035 mol
⇒ Khối lượng hỗn hợp m = 0,035.60 = 2,1 gam.
I.54. * Axit no đơn chức .png)
Este no đơn chức .png)
.png)
Nhận xét: Hỗn hợp hai chất này khi cháy thu được số mol .png) bằng số mol
bằng số mol .png) .
.
.png)
Theo định luật bảo toàn khối lượng:
.png)
I.55. .png)
.png)
Áp dụng định luật bảo toàn nguyên tố oxi, ta có:
.png)
I.56. .png) = 0,5.0,4 = 0,2 mol
= 0,5.0,4 = 0,2 mol
.png)
.png) tác dụng với este A = 0,5 – 0,2 = 0,3 mol
tác dụng với este A = 0,5 – 0,2 = 0,3 mol
• Nhận xét: Tỉ lệ mol .png)
Suy ra A phải là este 3 chức, tạo bởi axit đơn chức và ancol ba chức, dạng .png) .
.
.png)
R' = 41 ⇒ R' là gốc hóa trị ba .png)
Vậy CTPT của este A là .png) .
.
I.57. .png) = 1,5.0,1 = 0,15 mol
= 1,5.0,1 = 0,15 mol
Este là RCOOR'
.png)
.png) = 10,8: 0,15 = 72; R + 44 + R' = 72, vì R'
= 10,8: 0,15 = 72; R + 44 + R' = 72, vì R' .png) 15
15
⇒ R = 1 = H và R' = 27. Este là .png) .
.
(Các sản phẩm thu được khi tác dụng với KOH là HCOOK và .png) -CHO đều có phản ứng tráng gương).
-CHO đều có phản ứng tráng gương).
Chọn A.
I.58.
.png)
Khi cân bằng:
.png)
Chọn V = 1 lít
.png)
I.59.
.png)
Hằng số cân bằng .png)
[ ] là nồng độ mol/l lúc cân bằng.
Chọn thể tích hỗn hợp V = 1 lít.
.png)
• Khi đạt hiệu suất, 90% axit phản ứng:
.png)
Vì K không phụ thuộc nồng độ.
Ta có: .png)
x = 2,925.
I.60.
.png)
Giải được 2 nghiệm x1 = 3,155 (loại)
x2 = 0,845 (nhận)
% ancol phản ứng = .png) = 84,5%.
= 84,5%.
I.61. Etyl axetat .png) (M = 88)
(M = 88)
.png) = 0,1 mol;
= 0,1 mol; .png) = 0,2 mol
= 0,2 mol
.png)
Chất rắn gồm : .png)
I.62. Axit metacrylic .png)
rượu metylic .png) (M = 32)
(M = 32)
.png)
Vì hiệu suất 60% nên khối lượng este thực tế thu được là m' = m.60%
.png)
I.63. n NaOH = 1.0,19 = 0,19 mol ⇒ n hỗn hợp 2 axit = n NaOH = 0,19 mol
.png) = 9,2 : 46 = 0,2 mol
= 9,2 : 46 = 0,2 mol
Thay 2 axit bằng RCOOH (0,19 mol)
.png)
(lượng este lí thuyết tính theo axit).
Theo phản ứng
Cứ 1 mol axit → 1 mol este, .png) tăng 28 gam.
tăng 28 gam.
Vậy 0,19 mol axit → 0,19 mol este, .png) tăng 5,32 gam.
tăng 5,32 gam.
⇒ Khối lượng este lí thuyết = 10 + 5,32 = 15,32 gam.
Vì H = 90%, nên lượng este thực tế thu được là:
15,32.90% = 13,788 gam.
Chọn A.
(Cũng có thể tính lượng este theo định luật bảo toàn khối lượng).
I.64. * Hỗn hợp X + NaOH?
Thay axit và este bằng RCOOR'
RCOOR' + NaOH → RCOONa + R'OH
.png) = 0,4.0,25 = 0,1 mol
= 0,4.0,25 = 0,1 mol
• Axit no đơn chức và este no đơn chức có cùng dạng công thức là .png)
.png)
Suy ra axit và este có cùng số cacbon là 3 ⇒ công thức phân tử đều là .png) .
.
I.65. Nhận xét: .png) ⇒ este 3 chức
⇒ este 3 chức
Vì este mạch hở tạo bởi axit đơn chức và ancol ba chức nên có dạng .png)
.png)
(R +44 +23)0,075 = 7,05
R = 27 ⇒ R là gốc .png)
Mặt khác:
.png) = (27 +44)3 + R' = 254
= (27 +44)3 + R' = 254
R' = 41 ⇒ R' là gốc .png) hóa trị 3
hóa trị 3
Vậy este là .png)
I.66. .png) = 1,064 : 22,4 = 0,0475 mol
= 1,064 : 22,4 = 0,0475 mol
Phần 1: .png)
Phần 2: .png) = 4,6 : 46 = 0,1 mol, nên lượng este tính theo axit
= 4,6 : 46 = 0,1 mol, nên lượng este tính theo axit
.png)
.png)
I.67. .png) = 0,1.1,5 = 0,15 mol
= 0,1.1,5 = 0,15 mol
Hai este: .png)
.png)
Suy ra trong 2 este phải có một este có M < 64,66. Este đó chỉ có thể là .png) (M = 60). Theo giả thiết cho, este còn lại là
(M = 60). Theo giả thiết cho, este còn lại là .png) .
.
I.68. n A = 17,6 : 88 = 0,2 mol n NaOH = 0,3 mol
.png)
Bã rắn gồm .png)
(R +44 +23)0,2 = 19,2
R = 29 ⇒ R là gốc .png)
R' = 15 ⇒ R' là gốc .png)
CTCT của este .png)
I.82. metylmetacrilat .png)
.png)
Trong phản ứng trùng hợp
.png)
I.83. * Chỉ số xà phòng của chất béo
n KOH = 0,1.0,09 = 0,009 mol
m KOH = 0,009.56 = 0,504 g = 504 mg
Chỉ số xà phòng của chất béo là:
.png)
* Chỉ số axit của chất béo
- Khối lượng glixerol khi xà phòng hóa 2,52 g chất béo là:
.png)
- Khối lượng KOH tác dụng với .png)
.png)
m = 0,484 g = 484 mg
Chỉ số axit = .png)
I.84. n KOH = 0,1.0,003 = 0,0003 mol
m KOH = 0,0003.56 = 0,0168 g = 16,8 mg
Chỉ số axit của chất béo = .png)
I.85. n KOH = n NaOH = 0,1.0,006 = 0,0006 mol
m KOH = 0,0006.56 = 0,0336 g = 33,6 mg
Chỉ số axit = .png)
I.86. m NaOH = 120.20% = 24 kg
Chất béo trung tính (không lẫn axit): .png)
.png)
Áp dụng định luật bảo toàn khối lượng:
.png)
I.88.
.png)
Lượng glixerol thực tế thu được là m’ = m.85%
.png)
I.89. * Cần chú ý rằng este và axit cùng loại có cùng dạng công thức phân tử.
* Gọi este có 2 liên kết II ở mạch cacbon cũng như axit có 2 liên kết và 2 nhóm chức .png) ở mạch cacbon và 2 nhóm chức:
ở mạch cacbon và 2 nhóm chức:
.png)
* Đặt x + 2 = n
⇒ Số C = n; số H = 2x - 2 = 2(x + 2) – 6 = 2n - 6
Số O = 4
* Công thức phân tử este X là: .png)
Chọn A.
I.90. Lipit .png) ; m NaOH = 40,15% = 6 kg
; m NaOH = 40,15% = 6 kg
.png)
